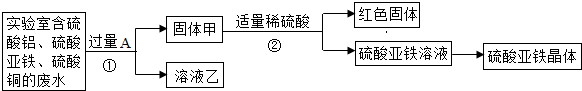
题目内容
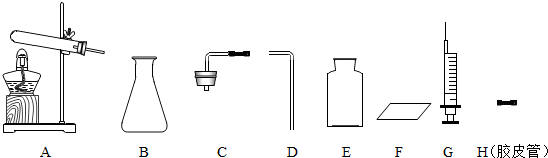
小明用含有少量二氧化碳的一氧化碳气体,先制取纯净、干燥的一氧化碳,再还原三氧化二铁,并验证反应产物.请根据图所示实验装置回答下列问题(其中A处框图表示盛有CO2和CO混合气体的储气瓶).(1)装置连接的正确顺序是______.(填序号)
(2)D装置中能观察到的现象是______;该装置内所发生反应的化学方程式是______.
(3)C装置的作用是______.
(4)E装置点燃尾气的原因是______.

【答案】分析:(1)仪器连接顺序:除去二氧化碳→干燥纯净的一氧化碳→CO气体还原氧化铜→检验气体生成物的性质→除尾气.
(2)根据一氧化碳还原氧化铜后有二氧化碳生成解答.
(3)依据氢氧化钠能与二氧化碳反应的知识分析问题;
(5)已知“混合气体,其主要成分为CO”,尾气中一定会有未反应的一氧化碳,如果不处理,会污染空气.
解答:解:(1)根据实验目的,仪器连接顺序为:混合气体→除去二氧化碳→干燥纯净的一氧化碳→CO气体还原氧化铜→检验气体生成物的性质→除尾气.
(2)一氧化碳还原氧化铜生成的二氧化碳能使石灰水变浑浊;反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
(3)装置C中是氢氧化钠溶液,它能和二氧化碳反应,从而起到吸收二氧化碳除掉二氧化碳的作用;
(4)混合气体中含有有毒的一氧化碳,故E装置点燃尾气的原因是防止一氧化碳污染空气.
故答案为:(1)A、C、B、F、D、E
(2)石灰水变浑浊;Ca(OH)2+CO2=CaCO3↓+H2O
(3)除去混合气体中的CO2 (4)防止CO污染空气
点评:本题考查一氧化碳和二氧化碳的性质和检验方法,掌握仪器的连接方法,学会除掉混合物气体内杂质的方法.
(2)根据一氧化碳还原氧化铜后有二氧化碳生成解答.
(3)依据氢氧化钠能与二氧化碳反应的知识分析问题;
(5)已知“混合气体,其主要成分为CO”,尾气中一定会有未反应的一氧化碳,如果不处理,会污染空气.
解答:解:(1)根据实验目的,仪器连接顺序为:混合气体→除去二氧化碳→干燥纯净的一氧化碳→CO气体还原氧化铜→检验气体生成物的性质→除尾气.
(2)一氧化碳还原氧化铜生成的二氧化碳能使石灰水变浑浊;反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
(3)装置C中是氢氧化钠溶液,它能和二氧化碳反应,从而起到吸收二氧化碳除掉二氧化碳的作用;
(4)混合气体中含有有毒的一氧化碳,故E装置点燃尾气的原因是防止一氧化碳污染空气.
故答案为:(1)A、C、B、F、D、E
(2)石灰水变浑浊;Ca(OH)2+CO2=CaCO3↓+H2O
(3)除去混合气体中的CO2 (4)防止CO污染空气
点评:本题考查一氧化碳和二氧化碳的性质和检验方法,掌握仪器的连接方法,学会除掉混合物气体内杂质的方法.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目