题目内容
【题目】Ⅰ.请从下列物质中选择相应的序号填空:
①淀粉 ②烧碱 ③熟石灰 ④小苏打 ⑤硝酸钾
(1)可作复合肥的是__ ;
(2)可用来治疗胃酸过多症的是_____;
(3)可用来改良酸性土壤的是____;
(4)米和面中含有的糖类物质主要是_____。
Ⅱ.根据所学知识填空:
①以下是某同学的午餐菜谱:A 米饭 B 牛肉 C 鱼 D 青菜。其中富含蛋白质的是__(填序号);
②做菜时加了含铁强化酱油,其中微量元素铁可以预防____ 。
Ⅲ.(1)现有Fe、CuO、稀H2SO4、NaOH溶液、CuSO4溶液、MgSO4溶液六种物质,两两混合后常温下共能发生__个反应,其中属于复分解反应的有____个。
(2)某同学向AgNO3、Cu(NO3)2、Fe(NO3)2、Mg(NO3)2混合溶液中加入一定质量的锌粉,充分反应后过滤,得滤液和滤渣。
①若向滤液中加入少量的盐酸,发现有白色沉淀产生,则滤液中一定含有的盐有____种;
②若向滤渣中加入稀盐酸,发现有气泡产生,则滤渣中一定有______;
③若所得滤液为无色,则滤渣中一定有____。
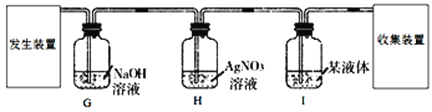
Ⅳ.下列A~D是初中化学中的四个实验装置,请按要求填空:
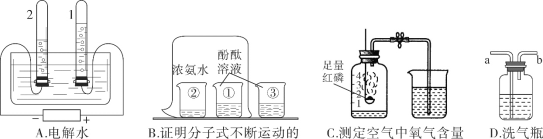
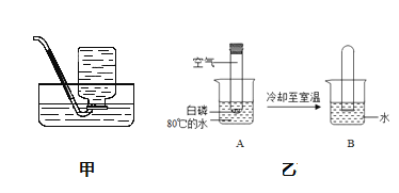
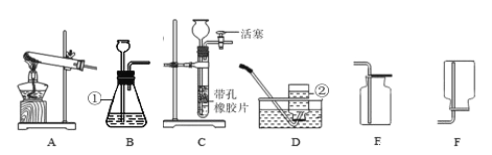
(1)A实验:试管2中产生的气体是____;
(2)B实验:烧杯③的作用是____;
(3)C实验:下列操作不妥的是____;
①红磷要足量;②实验前夹紧止水夹;③冷却后再打开止水夹;④用木炭代替红磷
(4)若用D装置除去O2中的水蒸气,其中的液体试剂为____。
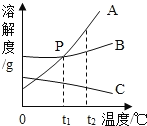
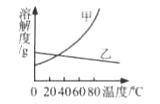
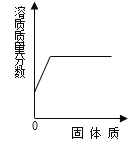
Ⅴ.A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示:
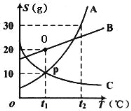
(1)t1℃时,B物质的溶解度是____g;
(2)可以通过____的方法使处于O点状态的B溶液变为P点状态的B溶液;
(3)若将t2℃时三种物质的饱和溶液分别降温到t1℃,降温后溶质质量分数最小的是____物质的溶液(填“A”、“B”或“C”)。
【答案】⑤ ④ ③ ① BC 贫血 6 4 5 Ag、Cu、Fe Ag、Cu、Fe 氢气或H2 对比实验,证明使酚酞试液变红的不是空气 ④ 浓硫酸 20 加水 C
【解析】
Ⅰ:(1)硝酸钾中含有钾元素和氮元素,常作为复合肥料使用,故填:⑤;
(2)小苏打能与胃酸中的盐酸反应,所以可用于治疗胃酸过多,故填:④;
(3)氢氧化钙具有碱性,常用降低土壤酸性,故填:③;
(4)米和面中含有的糖类物质主要是淀粉;故填:①。
Ⅱ:(1)米饭中富含糖类、牛肉和鱼中富含蛋白质、青菜中富含维生素;故选BC;
(2)微量元素铁可以预防缺铁性贫血。
Ⅲ:利用各种反应的发生要求可知Fe、CuO、稀H2SO4、NaOH溶液、CuSO4溶液、MgSO4溶液六种物质,两两组合时:Fe粉和稀硫酸反应生成硫酸亚铁和氢气;Fe粉和CuSO4溶液反应生成硫酸亚铁和铜单质;氧化铜和稀硫酸生成硫酸铜和水;稀硫酸和氢氧化钠溶液生成硫酸钠和水;氢氧化钠溶液和硫酸铜溶液生成氢氧化铜沉淀和硫酸钠,氢氧化钠和硫酸镁溶液生成氢氧化镁沉淀和硫酸钠,一共6个反应。其中后4个反应符合复分解反应特征。
(2)由金属活动顺序表知:镁>锌>铁>铜>银,所以加入锌粉,首先锌粉和硝酸银溶液反应,置换出单质银,如果锌粉足量可以再继续和硝酸铜反应置换出铜,然后再与硝酸亚铁反应,锌不会与硝酸镁反应。
①若向滤液中加入少量的盐酸,发现有白色沉淀产生,滤液中一定含有硝酸银,锌和硝酸银反应生成硝酸锌和银,所以滤液中一定含有的盐有硝酸镁、硝酸锌、硝酸亚铁、硝酸铜、硝酸银5种;
②若向滤渣中加入稀盐酸,发现有气泡产生,说明滤渣中一定含有铁,所以滤渣中一定有铁、铜、银;
③若所得滤液为无色,滤液中一定不含硝酸亚铁和硝酸铜,所以滤渣中一定有银、铜、铁。
Ⅳ:(1)据图可以看出2试管中产生的气体体积大,是氢气;
(2)烧杯③是想说明酚酞在空气中不变色,起到了对比的作用;
(3)①红磷足量能将氧气全部消耗尽,合理,不符合题意;
②实验前夹紧止水夹能防止燃烧时温度升高将瓶中的其他气体排出瓶,合理,不符合题意;
③冷却后打开止水夹能测定的准确,合理,不符合题意;
④用木炭代替红磷燃烧生成的是二氧化碳,瓶内气体体积不变,无法测定,不合理,符合题意;故选④;
(4)浓硫酸具有吸水性,能作干燥剂;
Ⅴ:(1)由溶解度曲线可知:t1℃时,B物质的溶解度是20g;
(2)O点状态的B溶液为饱和溶液,P点状态的B溶液为不饱和溶液,可以通过增加溶剂的方法使处于O点状态的B溶液变为P点状态的B溶液;
(3)A、B物质的溶解度随温度的降低而降低,C随温度的降低而升高。t2℃时,C物质的溶解度最小,小于A、B物质t1℃时的溶解度,所以将t2℃时三种物质的饱和溶液分别降温到t1℃,C的质量分数不变,降温后溶质质量分数最小的是C物质的溶液。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
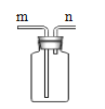
小学生10分钟应用题系列答案【题目】兴趣小组借助如图装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。

(1)实验前用砂纸打磨铁钉至光亮的目的是_____。
(2)已知试管剩余空间和导管的体积为20mL,导管截面积约为1cm2,充分反应后,形成稳定液柱时,读取读数为4.1cm,则空气中氧气的体积分数为_____%(保留小数点后一位)。
(3)实验时发现上述测量过程因反应较慢耗时较长,现对影响铁生锈速率的因素作如下
(提出假设)假设一:溶液的酸碱度;
假设二:NaC1溶液的浓度;
请你再提出一种影响铁生锈快慢的因素。
假设三:_____。
(实验探究)借助上述实验装置,通过控制铁钉用量等其他条件均相同时,调节溶液的pH获得了如表实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度(cm) | 0 | 0.6 | 4.1 | 4.1 | 4.1 | 4.1 |
形成稳定液柱时间(min) | 3.0 | 3.0 | 5.1 | 5.3 | 15.6 | 17.5 |
(实验结论)根据实验数据分析,为缩短实验测定时间,pH的最佳范围是_____;还可以采取何种方法进一步缩短实验时间_____(答一条即可)。
(实验反思)当pH=2时,没有观察到稳定液柱形成的原因是_____。