题目内容
过氧化钠(Na2O2)固体是登山队员常用的供氧剂,它能和CO2反应生成Na2CO3和O2(2Na2O2+2CO2=2Na2CO3+O2↑),产生O2供人呼吸.试计算:(计算结果保留一位小数)(1)312gNa2O2与足量CO2反应可产生氧气
(2)若将156gNa2O2投入500g水中,发生反应(2Na2O2+2H2O=4NaOH+O2↑)后,溶液中NaOH溶质的质量是多少克?所得NaOH溶液的质量分数是多少?
分析:(1)化学反应中,反应物和生成物之间存在一定的质量关系,这种质量关系与物质的相对分子量和物质的化学计量密不可分.因此,化学反应中的有关计算,可以根据化学方程式中物质之间恒定的质量比进行.Na2O2与CO2反应可产生氧气,化学方程式为:2Na2O2+2CO2=2Na2CO3+O2↑,根据过氧化钠和氧气的相对分子量,列比利式即可求得312gNa2O2与足量CO2反应可产生氧气的质量.
(2)将156gNa2O2投入500g水中,一要考虑156gNa2O2是不是全部反应掉;二要注意反应后产生的氧气会逃逸掉,不存在溶液中.再根据发生反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑找出已知质量和未知量之间的关系,由溶质的质量分数=
×100%
即可求得正确答案.
(2)将156gNa2O2投入500g水中,一要考虑156gNa2O2是不是全部反应掉;二要注意反应后产生的氧气会逃逸掉,不存在溶液中.再根据发生反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑找出已知质量和未知量之间的关系,由溶质的质量分数=
| 溶质的质量 |
| 溶液的质量 |
即可求得正确答案.
解答:(1)解:根据化学方程式,找出已知质量和未知量之间的关系
2Na2O2+2CO2=2Na2CO3+O2↑
2×78 2×16
312 x
列比利式求解
=
x=
=64.0(克)
故答案为:64.0克
(2)解:设156gNa2O2充分反应需水x克,根据化学方程式,找出已知质量和未知量之间的关系
2Na2O2+2H2O=4NaOH+O2↑
2×78 2×18
156 x
列比利式求解
=
x=
=36(克)
解得156gNa2O2充分反应需水36克,36克远远小于500克,也就是说156gNa2O2投入500g水中会全部反应掉.
再设156gNa2O2投入500g水中生成NaOH y克、O2z克,根据化学方程式,找出已知质量和未知量之间的关系
2Na2O2+2H2O=4NaOH+O2↑
2×78 4×40 2×16
156 y z
列比利式求解
=
=
y=
=160(克) z=
=32(克)
解得156gNa2O2投入500g水中生成NaOH160克、氧气32克.而氧气不易溶于水会逃逸掉,不存在反应后的溶液中.
由 溶质的质量分数=
×100%
得NaOH溶液的质量分数=
×100%≈25.6%
答:溶液中NaOH溶质的质量是160克,所得NaOH溶液的质量分数约为25.6%.
2Na2O2+2CO2=2Na2CO3+O2↑
2×78 2×16
312 x
列比利式求解
| 2×78 |
| 2×16 |
| 312 |
| x |
x=
| 312×8 |
| 39 |
故答案为:64.0克
(2)解:设156gNa2O2充分反应需水x克,根据化学方程式,找出已知质量和未知量之间的关系
2Na2O2+2H2O=4NaOH+O2↑
2×78 2×18
156 x
列比利式求解
| 2×78 |
| 2×18 |
| 156 |
| x |
x=
| 156×9 |
| 39 |
解得156gNa2O2充分反应需水36克,36克远远小于500克,也就是说156gNa2O2投入500g水中会全部反应掉.
再设156gNa2O2投入500g水中生成NaOH y克、O2z克,根据化学方程式,找出已知质量和未知量之间的关系
2Na2O2+2H2O=4NaOH+O2↑
2×78 4×40 2×16
156 y z
列比利式求解
| 2×78 |
| 4×40 |
| 156 |
| y |
| 2×78 |
| 2×16 |
| 156 |
| z |
y=
| 156×40 |
| 39 |
| 156×8 |
| 39 |
解得156gNa2O2投入500g水中生成NaOH160克、氧气32克.而氧气不易溶于水会逃逸掉,不存在反应后的溶液中.
由 溶质的质量分数=
| 溶质的质量 |
| 溶液的质量 |
得NaOH溶液的质量分数=
| 160 |
| 156+500-32 |
答:溶液中NaOH溶质的质量是160克,所得NaOH溶液的质量分数约为25.6%.
点评:本题主要是结合溶质的质量分数,考察了化学反应中根据化学方程式的有关计算.元素的相对原子量一般会在题干之外注明,但是常见原子的相对原子量一定要熟记,它便于我们在计算中应用.本题设置生活情境,使我们曾强了对这一学科实用性的认识.这将会成为今后命题的一个趋向.

练习册系列答案
相关题目
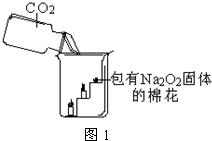


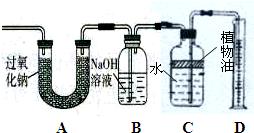 23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.
23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.