题目内容
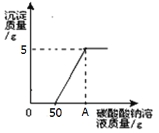
【题目】实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示。当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液。(提示:20℃时,氯化钠溶解度为36克。)
【答案】不饱和溶液
【解析】
试题分析:设50克10.6%的Na2CO3与稀盐酸反应生成NaCl的质量为X1,CO2的质量为a;要生成5克沉淀需Na2CO3溶液的质量为Y,同时生成NaCl的质量为X2.
Na2CO3 + 2HCl = 2NaCl +H2O + CO2↑
106 117 44
50g×10.6% X1 a
106∶117=50g×10.6%∶X1 106∶44=50g×10.6%∶a
X1=5.85 g a=2.2 g
CaCl2+Na2CO3 = 2NaCl +CaCO3↓
106 117 100
Y×10.6% X2 5 g
106∶100=Y×10.6%∶5 100∶117=5∶X2
Y=50 g X2=5.85 g
A点溶液的质量:50克+50克=100克
NaCl溶液中溶质质量分数为:( 5.85+5.85克)/(141.2g+100g-5g-2.2g) ×100%=5%
20℃时,饱和NaCl溶液的溶质质量分数为:36 g /(100g+36g) ×100%=26.5%
因为5% <26.5% 所以该溶液为不饱和溶液。

练习册系列答案
相关题目