题目内容
【题目】工业制取碳酸钠常会含有少量的氯化钠.实验探究小组欲测定碳酸钠样品中碳酸钠的质量分数,取该样品11g加入64.4g水形成不饱和溶液,然后向其中加入一定量的稀盐酸,恰好完全反应,所得溶液的溶质质量分数10%。产生二氧化碳的质量与时间的关系如图所示:
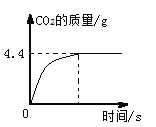
(1)求该样品中碳酸钠的质量分数.(结果精确到0.1%)
(2)求恰好完全反应时所加稀盐酸的质量.
【答案】(1)96.4% (2) 50g
【解析】
试题分析:根据图中数据可知,最终反应结束生成二氧化碳的质量是4.4g,根据化学方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑中二氧化碳与Na2CO3、NaCl的质量关系,可分别计算出Na2CO3、NaCl的质量,进一步计算该样品中碳酸钠的质量分数
解:设Na2CO3的质量为x,NaCl的质量为y
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
(1)106:44= x:4.4g
x=10.6g
该样品中碳酸钠的质量分数=10.6g/11g×100%=96.4%
(2)117:44= y:4.4g y=11.7g
故反应结束后得到的氯化钠溶液质量=11.7g÷10%=117g
然后根据反应后溶液的质量+反应产生的气体质量=反应前各物质及溶液的质量
故恰好完全反应时所加稀盐酸的质量117g+4.4g﹣11g﹣64.4g=50g

练习册系列答案
相关题目
【题目】以下事实对应的解释错误的是
序号 | 事实 | 解释 |
A | 在花园中可闻到花香 | 分子在不断运动 |
B | 用肉眼不能直接观察到CO2分子 | CO2分子很小 |
C | 50毫升水与50毫升乙醇混合,混合后总体积小于100毫升 | 分子之间有间隔 |
D | 冰受热变为水,水受热变为水蒸气 | 分子可以再分 |