��Ŀ����
����Ŀ��ͬѧ���������ᡢ���ᱵ���������ơ�̼����������ʵ���Һ����̽��ѧϰ��
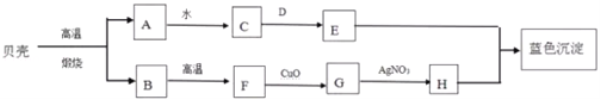
��ʵ��̽������ͼ��ʾ��A��B��C��D����ͬѧ�ֱ����������ʵ�飬��д��D�з�����Ӧ�Ļ�ѧ����ʽ ��
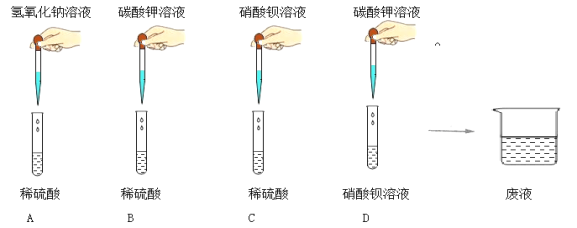
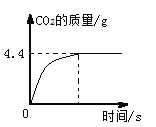
��ʵ����ۡ����ʵ�������ͬѧ����Һ����ͬһ���ձ��У��ٽ���Һ���ˣ��õ���ɫ��Һ�Ͱ�ɫ����������ɫ��Һ�еμ���ɫʯ����Һ����Һ��Ϊ��ɫ���ɴ��жϣ������İ�ɫ������ ����Һ��һ�������е������� ��
��ʵ����չ��Ϊ��֤����Һ�п��ܺ��е������Ƿ���ڣ��������ʵ�鷽��������֤��
��Һ�п��ܺ��е����� | ʵ�鲽�� | ʵ������ | ʵ����� |
���ܺ��� | ����Һ�еμ� | ������ɫ���� | ���и����� |
���𰸡���ʵ��̽����Ba��N03��2+K2CO3=BaCO3��+2KNO3
��ʵ����ۡ�BaSO4�������ᱵ�� OH����CO32-
��ʵ����չ��Ba2+ ϡ����
��������
�����������ʵ��̽�������ݸ��ֽⷴӦ�������ص㣬D�з�����Ӧ�Ļ�ѧ����ʽ��Ba��N03��2+K2CO3=BaCO3��+2KNO3
��ʵ����ۡ�����ɫ��Һ�еμ���ɫʯ����Һ����Һ��Ϊ��ɫ��˵����Һ�����ԣ���Һ�к���H+���������ӹ����ԭ������һ�������������ƺ�̼��أ��ʲ����İ�ɫ���������������ᱵ��Ӧ���ɵ����ᱵ��������Һ��һ�������е���������OH����CO32-
��ʵ����չ���������ķ�������Һ�п��ܺ��е������DZ����ӣ����鱵���Ӵ��ڣ�Ӧ����ϡ���ᣬ���Ƿ������˰�ɫ����������������ɫ��������˵�����б���������ʵ�鲽��������Һ�еμ�ϡ������ʵ��������������ɫ�������ó����ۣ�����������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�