题目内容
【题目】如图中A、B、C、D是4种粒子的结构示意图。请回答下列问题: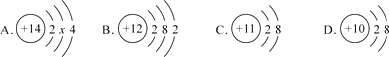
(1)A中x=D粒子的符号是
(2)A、B两种粒子表示的元素的原子可形成化合物B2A,该化合物(B2A)的化学式
(3)以上4种粒子的结构示意图中表示的是金属元素的离子(填字母代号)
【答案】
(1)8;Ne
(2)Mg2Si
(3)C
【解析】(1)同一原子中,质子数=核外电子数,A中x=8,D粒子的符号是Ne;(2)A表示的元素的原子是硅,B表示的原子是镁,可形成化合物B2A,该化合物的化学式:Mg2Si;(3) 原子的化学性质主要由最外层电子数决定,当最外层电子数小于4时,反应中易失去电子成为阳离子,属于金属元素;当最外层电子数大于4时,反应中易得到电子成为阴离子,属于非金属元素;原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构,不易得失电子,属于稀有气体元素。以上4种粒子的结构示意图中C表示的是金属元素的离子。在原子结构示意图中,小圆圈表示原子核,圆圈内的数字为质子数;弧线表示电子层,弧线上的数字为该层上的电子数。在原子中,原子序数=核电荷数=核内质子数=核外电子数;所以A是硅原子,B是镁原子,C是钠离子,D是氖原子;硅与镁形成的化合物为:Mg2Si;当最外层电子数小于4时,属于金属元素;当最外层电子数大于4时,属于非金属元素;原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构属于稀有气体元素。

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目