题目内容
某同学为验证质量守恒定律,向烧杯中加入40克溶质质量分数为20%的硫酸铜溶液,另取两只试管,向其中一只试管中加入一定质量的氢氧化钠溶液,向另一只试管中加入足量的稀硫酸.
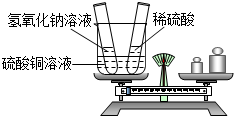
第一步:如图所示,将试管放入烧杯中并在天平上称重.
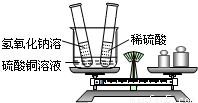
第二步:先将氢氧化钠溶液倒入烧杯中,能观察到的现象是 ;随后再将足量的稀硫酸倒入烧杯中,能观察到的现象是 .
第三步:将两只试管放回烧杯中,并将烧杯重新放在天平的左盘上,你能观察到天平指针 (填“偏左”、“偏右”或“保持不变”).
若使硫酸铜溶液与氢氧化钠溶液恰好完全反应,计算参加反应的氢氧化钠溶液中溶质的质量.
出现蓝色沉淀;蓝色沉淀溶解,得到蓝色的溶液;保持不变;参加反应的氢氧化钠溶液中溶质的质量为4g。
【解析】
试题分析:第二步:由于氢氧化钠和硫酸铜反应能够生成氢氧化铜的蓝色沉淀和硫酸钠,而氢氧化铜能够和稀硫酸反应生成硫酸铜和水,所以现象分别是:出现蓝色沉淀;蓝色沉淀溶解,得到蓝色的溶液。
第三步:由于反应前后没有物质从实验装置中跑出,所以依据质量守恒定律可知装置的质量不会变化,故天平指针不会偏转。设反应的氢氧化钠溶液中溶质的质量为x
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
80 160
x 40g×20%
 x=4g
x=4g
考点:本题考查质量守恒定律及其应用。

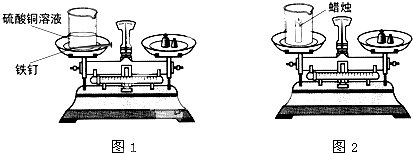
为验证质量守恒定律,某学习小组使用如图所示的装置进行实验:
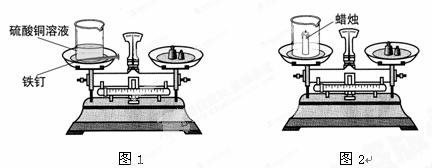 |
实验一:如图1,将盛有硫酸铜溶液的烧杯和用砂纸打磨干净的铁钉一起放在托盘天平上称量,天平平衡后,将铁钉浸到硫酸铜溶液中,一段时间后,观察现象。
实验二:如图2,同学们又用此装置做蜡烛在氧气中燃烧实验。
(1)实验一中,学生观察到溶液由蓝色逐渐变成绿色,铁钉表面有红色物质析出,说明 ,实验中还应观察到的现象是 。
(2)实验二中,学生没有得出正确的实验结论,分析原因并改进实验方案。

 (2013?历下区一模)某同学为验证质量守恒定律,向烧杯中加入40克溶质质量分数为20%的硫酸铜溶液,另取两只试管,向其中一只试管中加入一定质量的氢氧化钠溶液,向另一只试管中加入足量的稀硫酸.
(2013?历下区一模)某同学为验证质量守恒定律,向烧杯中加入40克溶质质量分数为20%的硫酸铜溶液,另取两只试管,向其中一只试管中加入一定质量的氢氧化钠溶液,向另一只试管中加入足量的稀硫酸.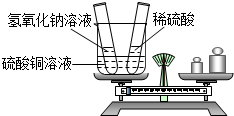 某同学为验证质量守恒定律,向烧杯中加入40克溶质质量分数为20%的硫酸铜溶液,另取两只试管,向其中一只试管中加入一定质量的氢氧化钠溶液,向另一只试管中加入足量的稀硫酸.
某同学为验证质量守恒定律,向烧杯中加入40克溶质质量分数为20%的硫酸铜溶液,另取两只试管,向其中一只试管中加入一定质量的氢氧化钠溶液,向另一只试管中加入足量的稀硫酸.