题目内容
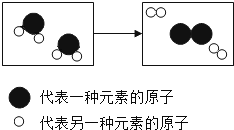
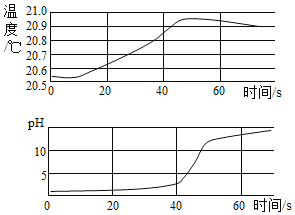
【题目】我国在 1993 年成功制取了一种由相对原子质量为18,核电荷数为8的氧原子构成的双原子分子气体。则下列说法正确的是( )
A.这种气体的相对分子质量为32
B.这种氧原子的核内有10个质子
C.这种氧原子的核外有10个电子
D.这种气体的相对分子质量为 36
【答案】D
【解析】
A、由两原子组成的分子称为双原子分子,同核双原子分子由两个相同元素组成,两原子大小相同,则这种气体的相对分子质量为![]() ,故A不正确;
,故A不正确;
B、在原子中,核电荷数=质子数=核外电子数,则这种氧原子的核内有8个质子,故B不正确;
C、在原子中,核电荷数=质子数=核外电子数,则这种氧原子的核外有8个电子,故C不正确;
D、这种气体的相对分子质量为![]() ,故D正确。故选D。
,故D正确。故选D。

 阅读快车系列答案
阅读快车系列答案【题目】在学习了CO2的性质后,同学们了解到SO2与CO2的性质有一定程度的相似性,于是一中教育集团化学兴趣小组的同学们,对SO2的性质进行实验探究。
[实验探究I]SO2与活泼金属反应的探究.
[查阅资料]镁条在CO2中剧烈燃烧的化学方程式为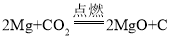 。
。
小开同学将点燃的镁条伸入装满SO2的集气瓶中,其实验现象为__________。
[实验探究II]SO2与NaOH溶液反应后生成的产物成分探究
[提出问题]SO2与NaOH溶液反应除生成水外,还可能有的生成物成分是什么?
[作出猜想]猜想1:亚硫酸钠(Na2SO3 )
猜想2:硫酸钠(Na2SO4);
猜想3:__________。
[查阅资料](1)Na2SO3能与酸反应产生SO2气体;
(2)SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸;
(3)Na2SO3有较强还原性,在空气中易被氧气氧化:![]() 。
。
[实验过程]甲、乙、丙三组同学分别进行实验探究:
小组 | 实验操作 | 现象 | 结论 |
甲组 | 将一定量SO2气体通入NaOH溶液中, 取少量反应后溶液于试管中,滴加少量稀盐酸 | 不产生气泡 | 猜想1不成立 |
乙组 | 将一定量SO2气体通入NaOH溶液中,取少量反应后溶液于试管中,滴加足量氯化钡溶液 | 生成白色沉淀 | 猜想2成立 |
[实验评价](1)甲组方案是否严谨__(填“严谨”或“不严谨”),请说明理由:________。
(2)丙组认为乙组的方案不严谨,理由是_________________。
(3)丙组的方案是____________。
[实验结论]猜想1成立
[实验反思]乙组同学在实验室拿来一瓶久置的亚硫酸钠溶液,取少量溶液与稀盐酸反应,没有看到气泡生成,大家讨论后,一致认为保存亚硫酸钠时应_________。
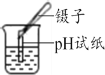
【题目】某课外活动小组的同学在整理化学药品柜时,发现一瓶标签受损的无色液体,如图所示.老师告诉大家,该瓶液体是下列5种液体中的某一种:稀H2SO4、H2O、MgCl2溶液、NaOH溶液、CuSO4溶液.
(1)根据以上信息判断,该无色液体一定不是_____和______.
(2)为确定该液体的成分,同学们设计了下列实验方案,请你一起参与同学们的探究活动.
实验操作 | 实验现象 | 实验结论 |
①取该液体适量于试管中,向其中滴加无色酚酞溶液 | 溶液颜色无变化 | 该液体不是______ |
②另取该液体适量于试管中,向其中加入锌粒 | ______ | 该液体是稀H2SO4, 不是MgCl2溶液 |
(反思交流)
(3)实验操作②中发生反应的化学方程是________.