题目内容
【题目】工业上常采用“天然苛化法”制取氢氧化钠,部分流程如下:
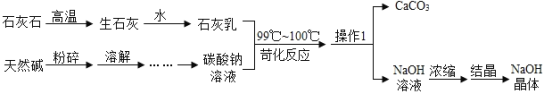
(1)操作1的名称是__________.
(2)写出流程中发生苛化反应的化学方程式_________.
(3)工艺中采用石灰乳而不用氢氧化钙溶液与碳酸钠反应,是因为______.
(4)生产工艺中可以回收再利用的物质是___________.
(5)由天然碱得到碳酸钠溶液时,将天然碱粉碎的目的是_________.
【答案】过滤 Na2CO3+Ca(OH)2![]() CaCO3↓+2NaOH 氢氧化钙微溶于水,溶液中的氢氧化钙含量太低,影响生成物的量 碳酸钙 加快溶解速率
CaCO3↓+2NaOH 氢氧化钙微溶于水,溶液中的氢氧化钙含量太低,影响生成物的量 碳酸钙 加快溶解速率
【解析】
(1)过滤可以将不溶性固体和液体分离,操作1的名称是过滤;
(2)流程中发生苛化反应是碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙沉淀,反应的化学方程式为:Na2CO3+Ca(OH)2![]() CaCO3↓+2NaOH;
CaCO3↓+2NaOH;
(3)工艺中采用石灰乳而不用氢氧化钙溶液与碳酸钠反应,是因为氢氧化钙微溶于水,溶液中的氢氧化钙含量太低,影响生成物的量;
(4)根据流程图可知:碳酸钙是苛化反应的生成物,又可用于制取生石灰,生产工艺中可以回收再利用的物质是碳酸钙;
(5)天然碱粉碎的目的是加快溶解速率。

 阅读快车系列答案
阅读快车系列答案【题目】兴趣小组的利用提供的试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液和紫色石蕊溶液。探究酸碱盐的性质。小清同学将氯化钠溶液加入到稀硫酸中没有观察到明显现象,而将混合溶液加热一段时间后,意外地闻到刺激性气味。
[提出问题]刺激性气味的气体是什么?
[猜想与假设]猜想1.可能是二氧化硫 猜想2.可能是氯化氢
猜想3.可能是氨气
大家讨论后认为猜想3不合理,依据是_____________________。
[查阅资料] SO2和CO2的化学性质相似,都能使澄清灰水变浑浊。写出二氧化硫和氢氧化钙的反应的化学方程式:____________________________。
[实验探究]如图所示,小诚将产生的气体通入紫色石蕊溶液中,观察到_________,于是他认为猜想2正确。
[评价与改进]小煜认为小诚的结论不科学,于是他利用提供的试剂通过实验确认了猜想2正确。
实验操作 | 实验现象 |
如图所示,将产生的气体________________ | _____________________ |
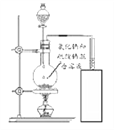
[结论]加热氯化钠与硫酸的混合溶液得到的气体是氯化氢
[拓展应用]实验室可用氯化钠和硫酸反应制取氯化氢气体,已知氯化氢气体极易溶于水。请推测实验室制取氯化氢气体最适宜的方法为________________(填序号)。
A.加热氯化钠溶液和稀硫酸的混合物 B.加热氯化钠固体和稀硫酸的混合物
C.加热氯化钠固体和浓硫酸的混合物