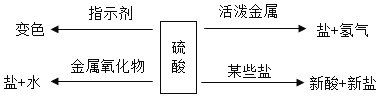
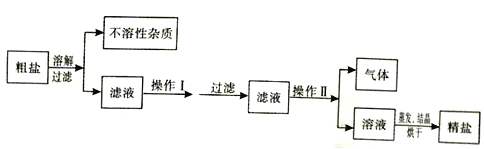
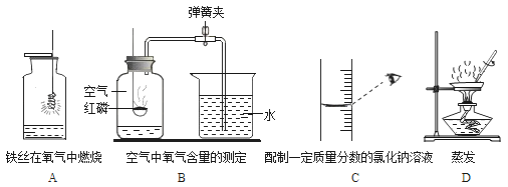
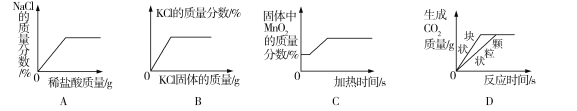
题目内容
【题目】课外小组同学进一步研究铁与氧气的反应.
(提出问题)铁丝燃烧时为什么会有“火星四射”的现象?
(查阅资料)铁丝燃烧时“火星四射”现象与铁丝含碳量有关.
(进行实验)探究铁丝在氧气中燃烧时“火星四射”的现象与其含碳量的关系.
实验 | 现象 | 解释与结论 |
实验1:取直径0.20mm、含碳0.1% 的铁丝,在氧气中燃烧 | 零星的火星四射 | ①铁燃烧的化学方程式是 ________ ②0.20mm的铁丝在氧气中燃烧,“火星四射”与其含碳量的关系为________ |
实验2:取直径0.20mm、含碳0.32%的铁丝,在氧气中燃烧 | 较明显的火星四射 | |
实验3:取直径0.20mm、含碳0.52%的铁丝,在氧气中燃烧 | ________ |
(提出问题)纯铁在氧气中燃烧溅落的“黑色固体”是什么?
(查阅资料)
①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO易被氧化)
②铁的氧化物均能溶于酸溶液
(进行实验)测定黑色固体的成分.
实验 | 现象及数据 | 解释与结论 |
实验4:将冷却后的黑色固体碾碎,装入试管,加入________溶液 | 现象是________ | 铁燃烧时溅落下来的黑色 固体中含有铁 |
实验5:取2.8g纯铁在氧气中燃烧,收集溅落的黑色固体,干燥并称其质量 | 黑色固体质量为3.44g | 黑色固体的组成及质量为 ________ |
(实验拓展)
同学们认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验.若用排水集气法收集一瓶体积分数约为80%的氧气,预先应向容积为360mL的集气瓶中加水,水的体积约为________ mL.
【答案】3Fe+2O2![]() Fe3O4明显的火星四射含碳量越高,火星四射的现象越明显稀盐酸有气泡产生Fe1.12g,Fe3O42.32g270
Fe3O4明显的火星四射含碳量越高,火星四射的现象越明显稀盐酸有气泡产生Fe1.12g,Fe3O42.32g270
【解析】
解:【进行实验】铁和氧气在点燃的条件下生成四氧化三铁,化学方程式是:3Fe+2O2![]() Fe3O4;铁在氧气燃烧的现象是剧烈燃烧,火星四射,生成黑色固体,通过对比可知铁丝含碳越高,火星越多,铁丝在氧气中燃烧产生火星四射现象与含碳量有关;
Fe3O4;铁在氧气燃烧的现象是剧烈燃烧,火星四射,生成黑色固体,通过对比可知铁丝含碳越高,火星越多,铁丝在氧气中燃烧产生火星四射现象与含碳量有关;
【进行实验】
铁和盐酸反应生成氯化亚铁和氢气,铁和氧气在点燃的条件下生成四氧化三铁,所以设参加反应的铁的质量为x,生成的四氧化三铁为y,
3Fe+2O2![]() Fe3O4
Fe3O4
168 232
x y
![]() y=
y=![]() ,
,
由题意得:2.8g-x+![]() =3.44g,x=1.68g,所以剩余的铁为:2.8g-1.68g=1.12g,生成的四氧化三铁为:3.44g-1.12g=2.32g;
=3.44g,x=1.68g,所以剩余的铁为:2.8g-1.68g=1.12g,生成的四氧化三铁为:3.44g-1.12g=2.32g;
【实验拓展】
设水的体积为z,由题意得:![]() 100%=80%,z=270ml。
100%=80%,z=270ml。

 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】某同学对下表中的溶解度数据分析后,得出的结论错误的是( )
温度/℃ | 0 | 20 | 40 | 60 |
氢氧化钙的溶解度/g | 0.18 | 0.16 | 0.14 | 0.11 |
硝酸钾的溶解度/g | 13.3 | 31.6 | 61.9 | 110 |
氯化钠的溶解度/g | 35.7 | 36 | 36.6 | 37.2 |
A. 升温可将20℃时不饱和的Ca(OH)2溶液变为饱和溶液
B. 60℃,饱和KNO3溶液的质量分数约为52.4%
C. 温度变化对NaCl的溶解度影响较小
D. NaCl的溶解度大于KNO3的溶解度
【题目】下图是我们所用课本中的一张,根据图示信息回答下列问题:

(1)该元素的核内质子数为________
(2)该原子的结构示意图为________
(3)若该元素元素的元素符号用A表示,则它与氧元素形成化合物的化学式为________
(4)下列对原子构成的理解错误的是_________(填字母)。
A.原子整体不显电性 |
B.原子核比原子小得多 |
C.原子核是不可分割的实心球体 |
D.原子质量主要集中在原子核上 |
(5)在元素周期表中,第二周期的八种元素中________相同。