题目内容
【题目】有碳酸钠、碳酸氢钠、氧化钙和氢氧化钙组成的混合物27.2g,把它们溶于足量的水里,发生反应可表示如下:
①CaO+H2O=Ca(OH)2
②Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
③NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
①+②:CaO+H2O+Na2CO3=CaCO3↓+2NaOH
①+③:CaO+NaHCO3=CaCO3↓+NaOH
此时溶液中的Ca2+、CO32-、HCO3-全部转化沉淀,将反应后的溶液蒸干,最后得到白色固体物质共29g,则原混合物中含Na2CO3的质量为( )
A.1.8gB.5.3gC.10.6gD.无法计算
【答案】C
【解析】
根据以上反应的化学方程式氧化钙会与水反应生成氢氧化钙,氢氧化钙和碳酸根离子、碳酸氢根离子会生成碳酸钙,反应后固体中增加的质量就是水的质量;然后根据反应的化学方程式找出质量关系进行计算解答。
解:通过以下反应的化学方程式
①![]()
②![]()
③![]()
①+②:![]()
①+③:![]()
分析可得反应后固体中增加的质量就是①+②反应中水的质量;
设原混合物中含Na2CO3的质量为x

![]()
x=10.6g
故选C。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
(工艺流程及原理)
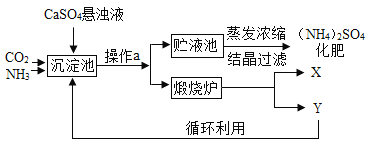
沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
(讨论交流)
(1)操作a的名称是______,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要______。
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用.Y的化学式为______。
(3)沉淀池中也可能生成少量NH4HCO3,该反应的化学方程式为______。
(硫酸铵化肥等级测定)
(1)判断(NH4)2SO4化肥中有无NH4HCO3:取少量试样溶于水,滴加足量的______,无气泡产生,则可判断该化肥中不存在NH4HCO3。
(2)化肥中氮元素含量的测定(已确定该化肥中不存在NH4HCO3杂质):
(查阅资料)
①已知:![]() ,氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
,氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
②工业判断硫酸铵化肥等级指标如下:
指标 项目 | 优等品 | 合格品 |
氮(N)含量 | ≥21.0% | ≥20.5% |
(实验设计)
按图所示装置进行实验.
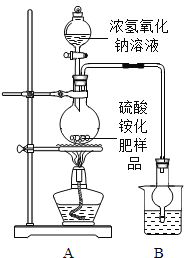
(1)实验过程中,往烧瓶中加入足量浓氢氧化钠溶液,并加热使硫酸铵充分反应完全转化为NH3.
(2)烧杯中的试剂是为了吸收产生的氨气,下列最适宜的试剂是______(填序号);
①水;②浓HCl;③稀H2SO4;④NaOH溶液
烧杯中干燥管的作用是______。
(交流讨论)
实验小组的同学认为,用上述实验装置测得的结果可能会出现下列情况.
(1)甲同学认为:应在实验装置A、B之间增加一个装有______(填“浓硫酸“或“碱石灰”)的干燥装置,否则实验测得的硫酸铵化肥含氮量可能偏高.
(2)乙同学认为:在实验装置A、B之间增加正确的干燥装置后进行实验,测得的硫酸铵化肥含氮量可能偏低,理由是______。
(实验测定)
经讨论后,他们改进了实验装置,排除了可能产生误差的因素,重新进行实验。取硫酸铵化肥样品13.5 g进行实验,测得B装置增重与反应时间的关系如图所示.请通过计算判断该化肥的等级.计算过程:_____;该化肥的等级为______品。

【题目】用下列实验操作可完成两个实验。请从A或B 两题中任选一个作答,若两题均作答,按A 计分。
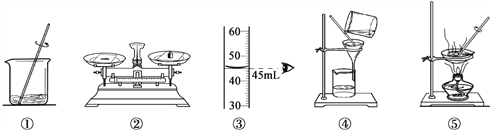
A去除粗盐中难溶性杂质 | B配制50g 10%的氯化钠溶液 |
(1)实验的操作步骤是___________(填序号)。 (2)实验中发现滤液浑浊,其原因是_____。 a.滤纸未贴紧漏斗内壁 b.滤纸破损 | (1)实验的操作步骤是____________(填序号)。 (2)实验后测得溶质质量分数<10%,其原因是_____。 a.装瓶时溶液洒出 b.烧杯中有水 |




