题目内容
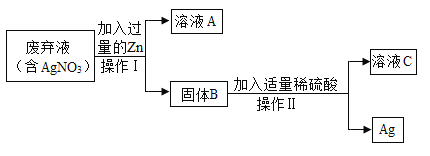
【题目】实验室以氧化铜、铁粉和稀硫酸为原料制备铜。
![]()
(1)写出I中反应的化学方程式_____;
(2)写出Ⅱ中反应的基本类型_____;
(3)对比铁和铜的金属性强弱_____。
【答案】![]() 置换反应 铁能够置换出铜,铁的金属性比铜强
置换反应 铁能够置换出铜,铁的金属性比铜强
【解析】
(1)由图可知,反应I是氧化铜与硫酸反应生成硫酸铜和水,故反应的化学方程式写为:CuO+H2SO4=CuSO4+H2O;
(2)由图可知,反应II是铁与硫酸铜反应生成硫酸亚铁和铜,该反应是一种单质与一种化合物反应生成另一种单质与另一种化合物的反应,符合置换反应的特点,属于置换反应,故填置换反应;
(3)金属活动性较强的金属可以将位于其后的活动性较弱的金属从其盐溶液中置换出来,从反应II可以判断,铁能够置换出铜,则铁的金属性比铜强,故填铁能够置换出铜,铁的金属性比铜强。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
【题目】某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。

实验次数 | 1 | 2 | 3 |
碳酸钠质量/克 | 0.53 | 1.06 | 2.12 |
反应前装置总质量/克 | 66.33 | 66.86 | 67.92 |
反应后装置总质量/克 | 66.19 | 66.62 | 67.42 |
(1)计算第1次反应产生的二氧化碳质量为______________。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律______________。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)