��Ŀ����
����Ŀ����1��Ҫ����50 g������������Ϊ11%���Ȼ�����Һ����Ҫˮ�����Ϊ_________mL��ˮ���ܶ���1 g��mL-1����
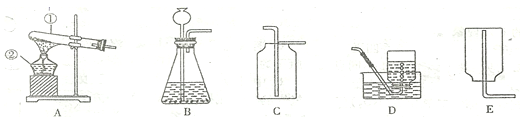
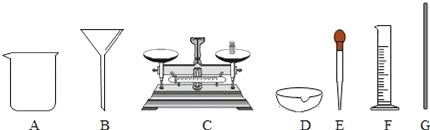
��2�����������Ȼ�����Һ�Ĺ���ͼ��˳�������Ҳ�ȫ���뽫�߿�����ȱ��ʵ�鲽��ͼ�����ֲ�ȫ�ں�����_____________________��
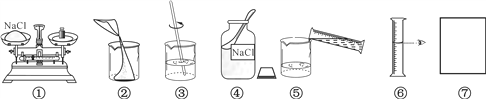
��3��С��ͬѧ����1���ͣ�2������ȷʵ�鲽�����ƺ���Һ���������Ƶ��Ȼ�����Һ���ʵ���������С��11%�����������������ƫС��ԭ�������_______������ţ���
A������ʱҩƷ������ŷ��� B����ȡˮʱ������Ͳ����
C����ȡ�õ��Ȼ��ƺ������� D�������õ����ʵ����ձ�ʱ�в�������
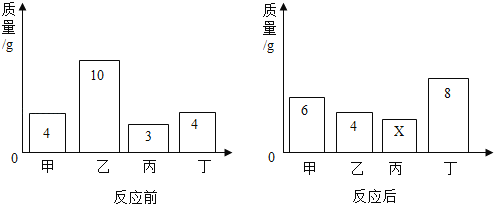
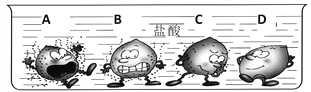
��4���������ᷴӦ�ľ��ҳ̶ȷ�ӳ�˽�����Ե�ǿ��������״����С��ͬ�Ĵ�����
A��B��C��Dͬʱ����װ������ϡ������ձ��У����¿�ͨͼ����ر����˴�ʵ����������ͼ��֪�������ǿ�Ľ�����______������ĸ���ţ���
��5������д��п��ϡ���ᷴӦ�Ļ�ѧ����ʽ��_______________________��
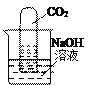
��6����ͼ��ʾ����һ֧����������̼������Թܵ���������������Һ�У�һ��ʱ����Թ���Һ�������ˣ����û�ѧ����ʽ��ʾ�������Ļ�ѧ��Ӧ��________________________________��
���𰸡� 44.5 װƿ��װƿ����ǩ��װ���Լ�ƿ�� A B C D A Zn��2HCl��ZnCl2��H2�� CO2��2NaOH��Na2CO3��H2O
����������1��50 g������������Ϊ11%���Ȼ�����Һ�У������Ȼ��Ƶ�����Ϊ�� ![]() �������ܼ�ˮ����Ϊ��
�������ܼ�ˮ����Ϊ�� ![]() ��ˮ���ܶ���1 g��mL-1 ��������Ҫˮ�����Ϊ44.5
��ˮ���ܶ���1 g��mL-1 ��������Ҫˮ�����Ϊ44.5![]() ����2�����ƺõ���Һ��Ҫװ���Լ�ƿ���ϱ�ǩ�� ��3��A������ʱҩƷ������ŷ��˻�����ҩƷ���Լ�����ƫС����������������ƫС��B����ȡˮʱ������Ͳ���������ܼ������ƫ����������������ƫС��C����ȡ�õ��Ȼ��ƺ������ʣ����Ȼ��Ƶ�������С����������������ƫС��D�������õ����ʵ����ձ�ʱ�в������������Ȼ��Ƶ�������С����������������ƫС����4�����ݿ�ͨͼ��֪����A���ᷴӦ���������5��п��ϡ���ᷴӦ�����Ȼ�п���������仯ѧ����ʽ��
����2�����ƺõ���Һ��Ҫװ���Լ�ƿ���ϱ�ǩ�� ��3��A������ʱҩƷ������ŷ��˻�����ҩƷ���Լ�����ƫС����������������ƫС��B����ȡˮʱ������Ͳ���������ܼ������ƫ����������������ƫС��C����ȡ�õ��Ȼ��ƺ������ʣ����Ȼ��Ƶ�������С����������������ƫС��D�������õ����ʵ����ձ�ʱ�в������������Ȼ��Ƶ�������С����������������ƫС����4�����ݿ�ͨͼ��֪����A���ᷴӦ���������5��п��ϡ���ᷴӦ�����Ȼ�п���������仯ѧ����ʽ�� ![]() ����6����һ֧����������̼������Թܵ���������������Һ�У�һ��ʱ����Թ���Һ�������ˣ��Ƕ�����̼���������Ʒ����˷�Ӧ���仯ѧ����ʽΪ��
����6����һ֧����������̼������Թܵ���������������Һ�У�һ��ʱ����Թ���Һ�������ˣ��Ƕ�����̼���������Ʒ����˷�Ӧ���仯ѧ����ʽΪ�� ![]() ��
��

 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д� �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д�����Ŀ��һЩʳ�����pH���±�������˵������ȷ���ǣ� ��
ʳ�� | ���� | ţ�� | ������ | ƻ��֭ |
pH | 4.0��4.4 | 6.3��6.6 | 7.6��8.0 | 2.9��3.3 |
A��θ��������Ӧ��ʳƻ�� B������֭��������ʳƷ
C��ţ�̺ͼ������Ϊ����ʳƷ D��ƻ��֭���Ա�ţ����