题目内容
有一种由氯化钠和硝酸钠组成的固体混合物12.35克,加入27克水溶解,滴入硝酸银溶液75克,恰好完全反应,生成氯化银沉淀14.35克.取反应后滤液40克,蒸发去26.5克水,冷却到10℃,溶液恰好饱和,计算:(1)根据质量守恒定律,反应后滤液的质量为______克.
(2)混合物中,氯化钠的质量.
(3)反应后滤液中溶质的质量分数.
(4)10℃时硝酸钠的溶解度.
【答案】分析:(1)根据质量守恒定律就是反应物的质量之和等于生成物的质量之和,进行计算.
(2)(3)利用化学方程式中已知氯化银的量可求氯化钠的质量及硝酸钠的质量,再利用溶质质量分数的计算求出滤液的溶质质量分数.
(4)利用题目所给的数据,结合溶解度的概念解决.
解答:解:(1)利用质量守恒定律可知反应前与反应后物质的质量不变,则反应后滤液的质量是12.35g+27g+75g-14.35g=100g
(2)(3)设固体混合物中氯化钠的质量为x,反应后生成硝酸钠的质量为y.
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5 85
x 14.35g y
(2) =
=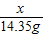 ,x=5.85g
,x=5.85g
(3) =
=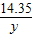 ,y=8.5g
,y=8.5g
反应后滤液中溶质的质量分数为: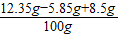 ×100%=15%
×100%=15%
(4)10℃时硝酸钠的溶解度是z
则有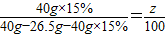
z=80g
答:(2)混合物中,氯化钠的质量是5.85g.(3)反应后滤液中溶质的质量分数是15%.(4)10℃时硝酸钠的溶解度是80g.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,属常规性化学方程式及溶解度计算题.
(2)(3)利用化学方程式中已知氯化银的量可求氯化钠的质量及硝酸钠的质量,再利用溶质质量分数的计算求出滤液的溶质质量分数.
(4)利用题目所给的数据,结合溶解度的概念解决.
解答:解:(1)利用质量守恒定律可知反应前与反应后物质的质量不变,则反应后滤液的质量是12.35g+27g+75g-14.35g=100g
(2)(3)设固体混合物中氯化钠的质量为x,反应后生成硝酸钠的质量为y.
NaCl+AgNO3=AgCl↓+NaNO3
58.5 143.5 85
x 14.35g y
(2)
 =
=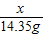 ,x=5.85g
,x=5.85g(3)
 =
=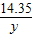 ,y=8.5g
,y=8.5g反应后滤液中溶质的质量分数为:
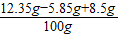 ×100%=15%
×100%=15%(4)10℃时硝酸钠的溶解度是z
则有
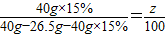
z=80g
答:(2)混合物中,氯化钠的质量是5.85g.(3)反应后滤液中溶质的质量分数是15%.(4)10℃时硝酸钠的溶解度是80g.
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,属常规性化学方程式及溶解度计算题.

练习册系列答案
相关题目