题目内容
我们已经学过实验室制取气体的一般思路和方法,请利用下列装置回答相关问题.

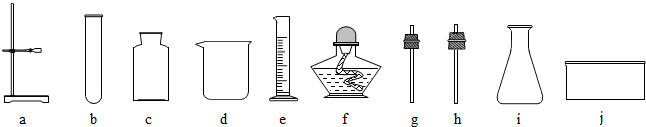
(1)写出图一中a和b的仪器名称:a b ;
(2)选择图一中的装置制取和收集二氧化碳气体,那么应选择的装置是 和 ;
在实验室中制取二氧化碳气体的常用药品:液体是 ,固体是 。
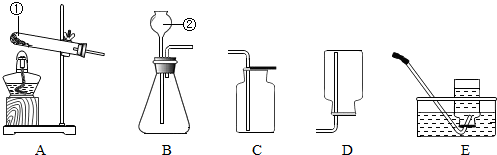
(3)若要用图二装置收集二氧化碳气体,则气体应从 (填c或d)端通.理由是 .
(4)用制取的二氧化碳进行如下有关性质实验:

①实验(II)中溶液变 色;
②实验(III)中加热之后,溶液又变为 色,解释出现此现象的原因 。
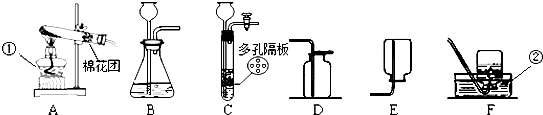
(5)实验室用高锰酸钾制取氧气的化学反应方程式(或化学式表达式) 若要用排水法收集一瓶较纯净的氧气,开始收集氧气的最佳时机是 。
(6)同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2。实验结束时,乙同学发现用排水法收集到的O2大于理论产量。针对这一现象,同学们进行了如下探究:
[提出猜想]猜想I:反应生成的MnO2分解放出O2;
猜想II:反应生成的K2MnO4分解放出O2;
猜想III:反应生成的K2MnO4和MnO2分解都放出O2。
[实验验证]同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。该组同学选择的实验方法是 。
[拓展延伸]实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。
请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么? 。
(1)a试管;b锥形瓶;(2)B和D;稀盐酸,大理石(石灰石);
(3)d;二氧化碳的密度大于空气的密度;
(4)①红;②紫色;碳酸不稳定加热而分解,溶液不再显酸性,石蕊又变为紫色;
(5)2KMnO4 △K2MnO4 + MnO2 + O2↑;导管口气泡连续,均匀冒出时;
(6)[实验验证] Ⅰ;将带火星的木条放入试管内;[拓展延伸]高锰酸钾不是催化剂,是因为加入高锰酸钾后,加热时高锰酸钾首先发生分解产生二氧化锰、锰酸钾和氧气,产生的二氧化锰能对氯酸钾分解起到催化作用,所以KClO3的分解速率大大加快。
【解析】
试题分析:由题中图可知图一中(1)a试管;b锥形瓶;(2) 选择图一中的装置制取和收集二氧化碳气体,因为反应物的状态为大理石是固体与稀盐酸是液体的反应,条件为常温,制得的二氧化碳能溶于水且密度比空气大,故不能用排水集气法,只能用向上排空气法,所以选择B和D;(3)因为二氧化碳的密度比空气的大,装置二相当于向上排空气法,所以气体应从d进;(4)因为二氧化碳能溶于水生成碳酸,所以①实验(II)中溶液变为红色,在加热的情况下碳酸分解生成二氧化碳和水,试液中没有酸性物质,所以②实验(III)中加热之后,溶液又变为紫色原因是:碳酸不稳定加热而分解,溶液不再显酸性,石蕊又变为紫色;(5) 实验室用高锰酸钾制取氧气的化学反应方程式(或化学式表达式)2KMnO4 △K2MnO4 + MnO2 + O2↑ 若要用排水法收集一瓶较纯净的氧气,开始收集氧气的最佳时机是:导管口气泡连续,均匀冒出时;(6)在[实验验证]中第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,说明MnO2在加热的情况下不生成氧气,所以猜想I错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论,说明生成了氧气,所以可利用氧气的助燃性来检验,将带火星的木条放入试管内进行检验即可;[拓展延伸]实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,的原因是:高锰酸钾不是催化剂,是因为加入高锰酸钾后,加热时高锰酸钾首先发生分解产生二氧化锰、锰酸钾和氧气,产生的二氧化锰能对氯酸钾分解起到催化作用,所以KClO3的分解速率大大加快。
考点:实验室制取气体的一般思路和方法及催化剂的探究