��Ŀ����
����Ŀ��ijʳ����Ʒ�к�����MgCl2��CaCl2�����ʣ���ʳ����Ʒ��ȡ����NaCl�Ĺ������£�
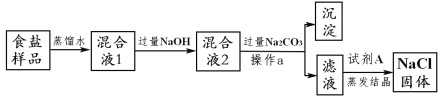
��1������a��������________,�Լ�A��������__________��
��2�����������NaOH��Һ����ȥ��������_______�������ӷ��ţ���
��3�����������Na2CO3��Һ����������Ӧ�Ļ�ѧ����ʽΪ_____
��4���Լ�A��������_____
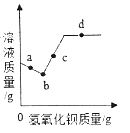
��5�����������ᾧ���IJ����У��������ʳ�ι���ɽ���Ϊ�������ٷɽ������ò��������Ͻ����⣬�����Բ�ȡ�ķ�����_____
���𰸡����� ϡ���� Mg2+ Na2CO3 + CaCl2 == 2NaCl + CaCO3�� ��ȥ������NaOH��Na2CO3 ���������г��ֽ϶����ʱ��ֹͣ���ȣ����Ъ���ȵȺ����𰸾��ɣ�
��������
��1�����˿ɽ�Һ��Ͳ����Թ�����з��룬�ʲ���a�������ǹ��ˣ�����������ϡ�����ȥ�������������ƺ�̼���ƣ����Լ�A��������ϡ���ᡣ
��2�����������NaOH��Һ��þ���Ӻ����������ӷ�Ӧ����������þ��������ȥ���������Ȼ�þ�е�Mg2+��
��3�����������Na2CO3��Һʱ��̼���ƺ��Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ���������Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+CaCl2�T2NaCl+CaCO3����
��4������������ϡ�����ȥ�������������ƺ�̼���ơ�
��5��Ϊ�������ٷɽ������ò��������Ͻ����⣬�����Բ�ȡ�ķ����ǵ��������г��ֽ϶����ʱ��ֹͣ���ȣ����Ъ���ȵȺ����𰸾��ɣ���

����Ŀ��ij��ѧ��ȤС��ͬѧ�˽�������Cl2���ǻ���ɫ���壬����ˮ��Һ����ˮ����ͬѧ�ǰ���ɫʯ����Һ�ӵ���ˮ�У�������Һ�ȱ�죬����ɫ��
���������ϣ�
��1����������ˮ��������C12���Ӵ�������Һ�У�������ˮ��ӦC12+H2O=HCl+HClO��
��2�������ᣨHCl����һ�����ᣬ����ǿ�����ԣ������ֽ⡣�䷴Ӧ����ʽΪ��2HClO![]() 2HCl+O2��
2HCl+O2��
�����������ʹ��ɫʯ����Һ������������ˮ�е������______��
��������⣩ʹ��ɫʯ����Һ��ɫ��������ʲô�أ�
��������룩
����1����ˮ�е�ˮʹ��ɫʯ����ɫ��
����2����ˮ�е�______ʹ��ɫʯ����ɫ��
����3����ˮ�е�����ʹ��ɫʯ����ɫ��
����4����ˮ�еĴ�����ʹ��ɫʯ����ɫ��
��ʵ��̽����ȡ�Ķ���ʯ����ҺȾ����ɫ�ĸ����ֽ����������ʵ�顣
ʵ����� | ʵ������ | ʵ����� |
����һ��ֽ����ˮ | ��û�����Ա仯 | ����1 ______ |
���ڶ���ֽ��ֱ�ӷ���ʢ�и���� ______ ����ƿ | ��û�����Ա仯 | ����2������ |
������ֽ������ϡ���� | ����죬�� ______ | ����3������ |
�����Ķ�ֽ������ˮ�� ______ | ���ȱ�죬����ɫ | ����4 ______ |
����չ̽����ʵ�����б�����ˮ�ķ�����______��
����˼�����ۣ�
��ȤС��ͬѧ�����̽�������е���һ������ʹ��ɫʯ����Һ��죬�������ʵ�鷽����ȡ�����������Թ��У����뼸����ɫʯ����Һ�����õι������μ�����������Һ�������Ͻ��裬����ɫ��ʧ��˵��ˮ���Ӻ�______���ѧ���ţ�����ʹʯ���졣
�����������ʵ�鷽��̽����֤��
ʵ����� | ʵ������ | ʵ����� |
______ | ______ | ______ |
����Ŀ���̷����㷺����ҽҩ��ҵ����ҵ�����û�ͭ��ۣ������ʣ���Ҫ�ɷ�ΪCuFeS2��ȡ�̷���FeSO4��7H2O��������ͼ����
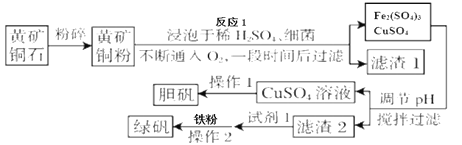
��������ϣ�
���������������ȶ����ڿ��������ױ���������������������
�������������ܺͽ�������Ӧ������ʽΪ��Fe2(SO4)3 + Fe = 3FeSO4
��FeSO4������ˮ���������Ҵ���
�ܲ���������������������ʽ��ȫ����ʱ��Һ��pH���±���
������ | ��ʼ����pH | ������ȫpH |
Cu(OH)2 | 4.2 | 6.7 |
Fe(OH)2 | 7.6 | 9.7 |
Fe(OH)3 | 1.5 | 2.8 |
��������
��1������ͭ��۴��Ŀ����____________��
��2���ڵ���pHʱ��Ϊ�˽�����2���ת��Ϊ��������������Ҫ������ҺpH�ķ�ΧΪ____________���ڵ���pHʱ�������������������ڣ���ѡ��NaOH��Һ���е��ڣ�������_______��
��3�����õ����̷��������Ҵ�ϴ�ӣ�����ˮ����ϴ�ӵ�Ŀ����_______��
��4����ͭ����ܹ���ϸ�������£������������������Ӧ����д����Ӧ1�Ļ�ѧ����ʽ_______