题目内容
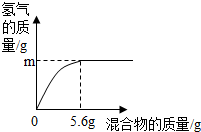
 现有两种金属单质组成的混合物.向100g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是
现有两种金属单质组成的混合物.向100g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是
- A.若混合物为Zn、Cu,则m一定大于0.2 g
- B.若混合物为Zn、Al,则m可能是0.2 g
- C.若混合物为Fe、Al,则稀盐酸中溶质质量分数一定小于7.3%
- D.若混合物为Fe、Cu,m为0.1 g,则该混合物中Fe的质量分数可能是50%
BD
分析:等质量的镁、铝、铁、锌和足量的酸反应时生成氢气的质量由多到少的顺序为:铝、镁、铁、锌,可以据此结合题给的选项进行分析.
解答:若混合物全是铁,则铁的质量为5.6 g,则根据化学反应的方程式:Fe+2HCl═FeCl2+H2↑可计算出此时产生氢气的质量等于0.2g,同理可计算出5.6gAl与盐酸反应产生氢气的质量大于0.2 g,5.6g锌与盐酸反应产生氢气的质量小于0.2 g,铜和盐酸不反应.
A、若混合物为Zn、Cu,则m一定小于0.2g,故A说法错误;
B、若混合物为Zn、Al,m可能等于0.2g,故B说法正确;
C、当混合物为Fe、Al时,因相同质量的铝消耗稀盐酸的质量比铁消耗盐酸的质量大,而5.6g铁时,消耗盐酸的质量为7.3g,所以混合物为Fe、Al时,消耗盐酸的质量大于7.3 g,根据质量分数公式可知所需盐酸溶质质量分数一定大于7.3%,故C说法错误;
D、若混合物为Fe、Cu,m为0.1g,生成0.1g氢气需要铁的质量是2.8g,则混合物种铁的质量分数为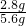 ×100%=50%,故D正确;
×100%=50%,故D正确;
故选BD.
点评:熟练掌握金属与酸反应的各个原理,并能熟练的运用,知道等质量的化合价为+2的金属,与足量的酸反应时,相对原子质量越大,则生成气体的质量越少这个规律.
分析:等质量的镁、铝、铁、锌和足量的酸反应时生成氢气的质量由多到少的顺序为:铝、镁、铁、锌,可以据此结合题给的选项进行分析.
解答:若混合物全是铁,则铁的质量为5.6 g,则根据化学反应的方程式:Fe+2HCl═FeCl2+H2↑可计算出此时产生氢气的质量等于0.2g,同理可计算出5.6gAl与盐酸反应产生氢气的质量大于0.2 g,5.6g锌与盐酸反应产生氢气的质量小于0.2 g,铜和盐酸不反应.
A、若混合物为Zn、Cu,则m一定小于0.2g,故A说法错误;
B、若混合物为Zn、Al,m可能等于0.2g,故B说法正确;
C、当混合物为Fe、Al时,因相同质量的铝消耗稀盐酸的质量比铁消耗盐酸的质量大,而5.6g铁时,消耗盐酸的质量为7.3g,所以混合物为Fe、Al时,消耗盐酸的质量大于7.3 g,根据质量分数公式可知所需盐酸溶质质量分数一定大于7.3%,故C说法错误;
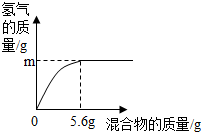
D、若混合物为Fe、Cu,m为0.1g,生成0.1g氢气需要铁的质量是2.8g,则混合物种铁的质量分数为
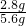 ×100%=50%,故D正确;
×100%=50%,故D正确;故选BD.
点评:熟练掌握金属与酸反应的各个原理,并能熟练的运用,知道等质量的化合价为+2的金属,与足量的酸反应时,相对原子质量越大,则生成气体的质量越少这个规律.

练习册系列答案
相关题目
 (2013?江宁区二模)现有两种金属单质组成的混合物.向100g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是( )
(2013?江宁区二模)现有两种金属单质组成的混合物.向100g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是( )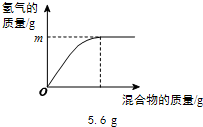 金属在生产生活中应用广泛.
金属在生产生活中应用广泛.