题目内容
【题目】草酸(H2C2O4)在一定条件发生如下反应:aH2C2O4 bH2O↑+cCO2↑+dX↑;取18g草酸,加热至完全分解,反应后测得生成水蒸气3.6g,二氧化碳8.8g。则下列说法正确的是( )
bH2O↑+cCO2↑+dX↑;取18g草酸,加热至完全分解,反应后测得生成水蒸气3.6g,二氧化碳8.8g。则下列说法正确的是( )
A. a=b+c+dB. 气体X中不含氢元素
C. b=2cD. 气体X的质量为2.8g
【答案】B
【解析】
质量守恒定律指的是参加反应的物质的质量总和等于生成物的物质的质量总和;根据生成的水和二氧化碳的质量,结合质量守恒定律的应用来分析解答本题;
A、根据质量守恒定律,反应物的质量等于生成的水、二氧化碳和X的质量总和,而不是a=b+c+d,选项A不正确;
B、18g草酸中H的质量是:18g×![]() =0.4g,生成的3.6g水中H的质量为:3.6g×
=0.4g,生成的3.6g水中H的质量为:3.6g×![]() =0.4g,故气体X中不含氢元素,选项B正确;
=0.4g,故气体X中不含氢元素,选项B正确;
C.根据反应的方程式可知,反应中生成水和二氧化碳的质量比为:18b:44c=3.6g:8.8g,可得b:c=1:1;即b=c;选项C不正确;
D.根据质量守恒定律,18g草酸完全反应分解生成X的质量为:18g﹣3.6g﹣8.8g=5.6g,选项D不正确;
故选:B。

 名校课堂系列答案
名校课堂系列答案【题目】草酸亚铁晶体(FeC2O4nH2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,某化学兴趣小组设计利用废弃铁锈合成草酸亚铁晶体并检验其热分解的产物及探究它的组成。
(一)制备草酸亚铁晶体(FeC2O4·nH2O)
资料1:FeSO4的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶解度/g | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | 59.8 |
资料2:草酸亚铁难溶于水,在酸性条件下稳定存在。
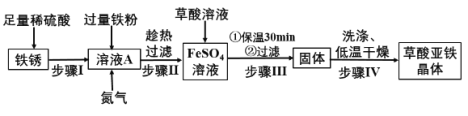
(制备流程)
(1)在实验室进行“过滤”操作时,需要的玻璃仪器有烧杯、漏斗和______,其作用是___
(2)步骤Ⅱ中趁热过滤的目的是______。
(3)草酸(H2C2O4)溶液加入FeSO4溶液中发生了复分解反应,请写出该反应的化学方程式为______。
(4)步骤Ⅲ中保温反应30min的目的是______。
(二)检验草酸亚铁晶体(FeC2O4·nH2O)热分解的产物及探究n的值
(实验装置)
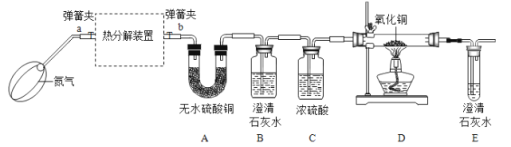
资料3:FeC2O4·nH2O加热至300℃完全失去结晶水;继续加热至400℃,剩余固体受热分解产生铁的氧化物、CO2和CO。
(实验分析)
(5)打开弹簧夹a、 b,先鼓入一段时间的氮气,然后再关闭a,加热分解装置的原因是______。
(6)若通过E装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解产生CO,则需在B和C装置之间增加盛有______(填试剂名称)的洗气瓶。
(7)装置D硬质玻璃管中出现的现象是______。
(8)取7.20gFeC2O4·nH2O,按上述实验步骤进行实验,测得热分解装置中固体质量随温度变化曲线如图所示:
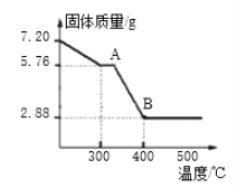
①FeC2O4·nH2O中n的值为______。(写出计算过程)
②若草酸亚铁晶体中混有杂质(杂质不参加反应),会导致测得的n的值______(选填“偏大”、“偏小”、“不变”)。/p>
③写出曲线中A至B发生反应的化学方程式______。