题目内容
某同学验证质量守恒定律时,将50g某质量分数一定的稀盐酸滴加到50g碳酸钠溶液恰好完全反应,反应后测得剩余液体的质量比反应前减少了4.4g.请认真分析并作答:
(1)该反应是否遵守质量守恒定律 (填“是”或“否”)
(2)该稀盐酸中溶质的质量分数;
(3)反应后溶液中溶质的质量分数.(精确到0.1%)
(1)该反应是否遵守质量守恒定律
(2)该稀盐酸中溶质的质量分数;
(3)反应后溶液中溶质的质量分数.(精确到0.1%)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:化学反应遵循质量守恒定律;
反应前后的质量差即为反应生成二氧化碳的质量;
根据二氧化碳的质量可以计算氯化氢的质量和反应生成的氯化钠的质量,进一步可以计算稀盐酸中溶质的质量分数和反应后溶液中溶质的质量分数.
反应前后的质量差即为反应生成二氧化碳的质量;
根据二氧化碳的质量可以计算氯化氢的质量和反应生成的氯化钠的质量,进一步可以计算稀盐酸中溶质的质量分数和反应后溶液中溶质的质量分数.
解答:解:(1)该反应遵守质量守恒定律.
故填:是.
(2)设氯化氢的质量为x,反应生成氯化钠的质量为y,
反应生成二氧化碳的质量是4.4g,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
73 117 44
x y 4.4g
=
=
,
x=7.3g,y=11.7g,
该稀盐酸中溶质的质量分数为:
×100%=14.6%,
答:该稀盐酸中溶质的质量分数为14.6%.
(3)反应后溶液中溶质的质量分数为:
×100%=12.2%,
答:反应后溶液中溶质的质量分数为12.2%.
故填:是.
(2)设氯化氢的质量为x,反应生成氯化钠的质量为y,
反应生成二氧化碳的质量是4.4g,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
73 117 44
x y 4.4g
| 73 |
| x |
| 117 |
| y |
| 44 |
| 4.4g |
x=7.3g,y=11.7g,
该稀盐酸中溶质的质量分数为:
| 7.3g |
| 50g |
答:该稀盐酸中溶质的质量分数为14.6%.
(3)反应后溶液中溶质的质量分数为:
| 11.7g |
| 50g+50g-4.4g |
答:反应后溶液中溶质的质量分数为12.2%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
元素周期表是学习和研究化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究,下列叙述错误的是( )
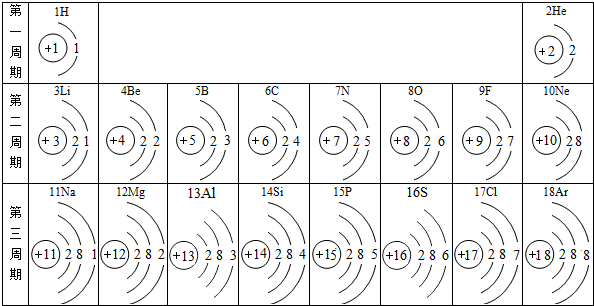

| A、第16号元素属于非金属元素,它在化学反应中容易得到电子 |
| B、同一周期中,原子的核外电子层数相同,最外层电子数从左向右逐渐增多 |
| C、金属离子的结构示意图与其原子的结构示意图中电子层数相 |
| D、元素的化学性质与原子结构中的最外层电子数关系密切 |

 (1)写出带有标号的仪器名称
(1)写出带有标号的仪器名称
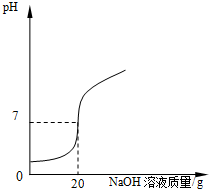 某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如图所示.
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如图所示. 质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题.
质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题.