题目内容
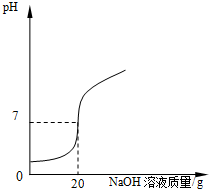 某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如图所示.
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为2%的氢氧化钠溶液进行中和,如图所示.(1)恰好完全中和废水中的盐酸所用的氢氧化钠溶液的质量是
(2)废水中盐酸的溶质质量分数是多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)因为NaOH和HCl完全反应后生成的NaCl溶液呈中性,故从图中分析可知当纵轴数值等于7时,对应的横轴值就是消耗氢氧化钠溶液的质量;
(2)根据NaOH和HCl反应的化学方程式,用氢氧化钠溶液中溶质NaOH的量可求出废液中溶质HCl的量,进而求出废液中HCl的质量分数;
(2)根据NaOH和HCl反应的化学方程式,用氢氧化钠溶液中溶质NaOH的量可求出废液中溶质HCl的量,进而求出废液中HCl的质量分数;
解答:解:
(1)NaOH和HCl完全反应后的溶液呈中性,即PH=7,有图可知此时消耗的氢氧化钠溶液为20g.
(2)解:设废水中HCl的质量为x
20g氢氧化钠溶液中含溶质NaOH的质量为20×20%=4g
NaOH+HCl=NaCl+H2O
40 36.5
4g x
=
x=3.65g
废水中盐酸的溶质质量分数=
×100%=0.73%
答案:
(1)20
(2)废水中盐酸的溶质质量分数0.73%
(1)NaOH和HCl完全反应后的溶液呈中性,即PH=7,有图可知此时消耗的氢氧化钠溶液为20g.
(2)解:设废水中HCl的质量为x
20g氢氧化钠溶液中含溶质NaOH的质量为20×20%=4g
NaOH+HCl=NaCl+H2O
40 36.5
4g x
| 40 |
| 36.5 |
| 4g |
| x |
x=3.65g
废水中盐酸的溶质质量分数=
| 3.65g |
| 50g |
答案:
(1)20
(2)废水中盐酸的溶质质量分数0.73%
点评:此题是有关溶液的计算题,主要是第2问计算质量分数,一定要牢记溶质质量分数的公式,另外计算数据要认真准确.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
 某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质. 如图A、B、C为三种物质的溶解度曲线,据图回答:
如图A、B、C为三种物质的溶解度曲线,据图回答: