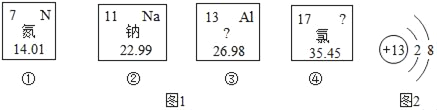
题目内容
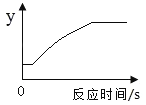
【题目】实验室用氯酸钾制备氧气,发生的反应为2KClO3![]() 2KCl+3O2↑.现取一定量的氯酸钾和二氧化锰进行加热,某变量y随时间的变化趋势如图所示。则y表示的是( )
2KCl+3O2↑.现取一定量的氯酸钾和二氧化锰进行加热,某变量y随时间的变化趋势如图所示。则y表示的是( )
A. 生成![]() 的体积 B. 生成KCl的质量
的体积 B. 生成KCl的质量
C. 固体中氧元素的质量 D. 固体中MnO2的质量分数
【答案】D
【解析】
A、氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,随着反应的进行,氧气的质量从零开始,逐渐增加,至完全反应,不再发生改变,故不符合题意;
B、氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,生成KCl的质量从零开始,逐渐增加,至完全反应,不再发生改变,故不符合题意;
C、反应后生成氧气跑掉,故固体中氧元素的质量从开始反应就不断减少,反应停止后不变,故不符合题意;
D、氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,固体质量不断减少,二氧化锰在反应中为催化剂,反应前后质量不变,固体中MnO2的质量逐渐增加,至完全反应,不再发生改变,故符合题意。

【题目】通过下列实验操作和现象能得出相应结论的是![]()
![]()
实验操作 | |||
A | 想收集满CO2的软塑料瓶中加入约1/3体积的水,旋紧瓶盖,振荡 | 塑料瓶变瘪 | CO2能与水反应 |
B | 把燃着的木条插入某瓶无色气体中 | 木条熄灭 | 该瓶中气体可能是二氧化碳 |
C | 把MnO2加入过氧化氢溶液中 | 快速产生气泡 | MnO2能增加O2的产量 |
D | 称量铜粉在空气中加热前后的质量 | 加热后的质量比原来铜粉的质量大 | 该化学反应不遵守质量守恒定律 |
A. AB. BC. CD. D
【题目】为探究锌、铜、铬三种金属的性质,某兴趣小组进行如下实验。
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。
【实验二】取粗细、长短相同的锌丝、铜丝、铬丝均与50mL稀硫酸反应,实验记录如下:
锌 | 铜 | 铬 | 铜 | |
稀硫酸的质量分数 | 5% | 5% | 15% | 15% |
反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
【实验三】金属锌、铜和稀硫酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。

(1)实验一的现象说明三种金属都具有____________性;
(2)铬与稀硫酸反应生成硫酸亚铬(CrSO4)和氢气,反应的化学方程式是______________________________________;该反应属于________________(填基本反应类型)反应;
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的________________放入________________的50mL稀硫酸中,观察放出气泡的快慢;
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是______(填序号)。
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能