题目内容
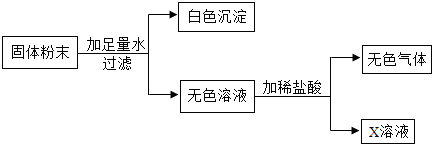
现有一包固体粉末,可能是CaCO3、Na2CO3、K2SO4、FeCl3、Ba(NO3)2、NaCl中的一种或几种,为确定其组成,小茜同学取适量试样进行下列实验.请你根据她的实验现象判断:(1)取试样于试管中,得浑浊状液体,静置后得白色固体和无色溶液.
(2)过滤,将白色固体放入试管中,滴加足量足量稀硝酸,有气泡产生,固体部分溶解.
(3)取步骤(1)的无色溶液少许于试管中,滴加足量稀盐酸,发现溶液中冒气泡.
通过以上现象可以得出结论:原粉末中一定不含 ,粉末中一定含有 ,可能含有 .步骤(1)中一定发生反应的化学方程式 ,
(4)小茜对可能含有的一种物质继续探究.她在步骤(3)所得溶液中滴加硝酸银溶液,有白色沉淀产生,则原粉末中一定含有该物质.小强对此质疑,认为此操作不能得到相应的结论,他的理由是 ,他说要想得到此结论,必须将上述实验中的一种试剂换成另外一种试剂,证实了该物质的存在.他把试剂换成了 ,除去了溶液溶液中一定存在的一种离子和可能存在的一种离子,分别是 .
【答案】分析:溶于水得到白色固体和无色溶液无色澄清溶液,说明原试样中无溶于水后显颜色的物质、有不溶于水的物质,排除FeCl3;过滤,将白色固体放入试管中,滴加足量足量稀硝酸,有气泡产生,固体部分溶解.说明含有能溶于酸的碳酸盐沉淀和不能溶解于稀硝酸的是硫酸钡,判断固体中一定有K2SO4、Ba(NO3)2;步骤(3)中已经引入了氯离子,故加入硝酸银溶液出现白色沉淀,只能确定清液中含氯离子,不能判断原溶液中一定含NaCl;要确定是否含NaCl,应该排除氯离子的干扰,所以在步骤(3)中不能引入氯离子,可以据此解答;
解答:解:溶于水得到白色固体和无色溶液无色澄清溶液,说明原试样中无溶于水后显颜色的物质、且有不溶于水的物质,排除FeCl3;过滤,将白色固体放入试管中,滴加足量足量稀硝酸,有气泡产生,固体部分溶解.说明含有能溶于酸的碳酸盐沉淀和不能溶解于稀硝酸的是硫酸钡,判断固体中一定有K2SO4、Ba(NO3)2;溶解的沉淀可能是碳酸钙或碳酸钠与硝酸钡反应生成的碳酸钡,步取步骤(1)的无色溶液少许于试管中,滴加足量稀盐酸,发现溶液中冒气泡,说明溶液中一定含有碳酸钠,通过以上现象可以得出结论:原粉末中一定不含FeCl3,粉末中一定含有 Na2CO3、K2SO4、Ba(NO3)2,可能含有 NaCl、CaCO3.步骤(1)中一定发生反应的化学方程式 K2SO4+Ba(NO3)2=BaSO4↓+2KNO3;
由于步骤(3)中已经引入了氯离子,故加入硝酸银溶液出现白色沉淀,不能确定清液中含氯离子,也就是不能判断原溶液中一定含NaCl;
要确定是否含NaCl,应该排除氯离子的干扰,且对溶液中存在的碳酸根和硫酸根(两者与银离子结合都有可能出现沉淀)予以排除,故该试剂应该是硝酸钡;由以上的分析可知溶液中一定含有碳酸根离子可能含有硫酸根离子;
故答案为:FeCl3; Na2CO3、K2SO4、Ba(NO3)2; NaCl、CaCO3;K2SO4+Ba(NO3)2=BaSO4↓+2KNO3;步骤3中引入了氯离子,所以无法判断是否有氯化钠存在;硝酸钡;CO32-、SO42-;
点评:本题为混合物成分推断题,完成此题,可以依据题干叙述的实验现象,结合物质的性质进行,要求同学们加强对物质性质的识记,以便灵活运用.
解答:解:溶于水得到白色固体和无色溶液无色澄清溶液,说明原试样中无溶于水后显颜色的物质、且有不溶于水的物质,排除FeCl3;过滤,将白色固体放入试管中,滴加足量足量稀硝酸,有气泡产生,固体部分溶解.说明含有能溶于酸的碳酸盐沉淀和不能溶解于稀硝酸的是硫酸钡,判断固体中一定有K2SO4、Ba(NO3)2;溶解的沉淀可能是碳酸钙或碳酸钠与硝酸钡反应生成的碳酸钡,步取步骤(1)的无色溶液少许于试管中,滴加足量稀盐酸,发现溶液中冒气泡,说明溶液中一定含有碳酸钠,通过以上现象可以得出结论:原粉末中一定不含FeCl3,粉末中一定含有 Na2CO3、K2SO4、Ba(NO3)2,可能含有 NaCl、CaCO3.步骤(1)中一定发生反应的化学方程式 K2SO4+Ba(NO3)2=BaSO4↓+2KNO3;
由于步骤(3)中已经引入了氯离子,故加入硝酸银溶液出现白色沉淀,不能确定清液中含氯离子,也就是不能判断原溶液中一定含NaCl;
要确定是否含NaCl,应该排除氯离子的干扰,且对溶液中存在的碳酸根和硫酸根(两者与银离子结合都有可能出现沉淀)予以排除,故该试剂应该是硝酸钡;由以上的分析可知溶液中一定含有碳酸根离子可能含有硫酸根离子;
故答案为:FeCl3; Na2CO3、K2SO4、Ba(NO3)2; NaCl、CaCO3;K2SO4+Ba(NO3)2=BaSO4↓+2KNO3;步骤3中引入了氯离子,所以无法判断是否有氯化钠存在;硝酸钡;CO32-、SO42-;
点评:本题为混合物成分推断题,完成此题,可以依据题干叙述的实验现象,结合物质的性质进行,要求同学们加强对物质性质的识记,以便灵活运用.

练习册系列答案
相关题目
现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.
查阅资料:Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解.甲同学认为红色粉末中只有Fe2O3,而乙同学认为可能只有Fe2O3也可能是Cu、Fe2O3的混合物,你认为______的观点正确(填“甲”或“乙”).
(2)丙同学为进一步确定红色粉末的组成,称取该粉末10.0g装入硬质玻璃管中,按如图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,记录两组数据如下表:
①由上表的数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是______的质量.实验中观察到A装置中的现象为______.
②应该选择______组的实验数据计算来确定红色粉末的组成.请你计算反应后固体中铁粉的质量 ( 写出计算过程 )最终计算结果表明:该红色粉末的组成是______
(3)①为了防止溶液倒吸,请判断本实验停止加热前是否需要先断开A和B的连接处并说明理由?______.
②从环保角度,上图装置有严重不足之处.你认为应该如何改进?______.

查阅资料:Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解.甲同学认为红色粉末中只有Fe2O3,而乙同学认为可能只有Fe2O3也可能是Cu、Fe2O3的混合物,你认为______的观点正确(填“甲”或“乙”).
(2)丙同学为进一步确定红色粉末的组成,称取该粉末10.0g装入硬质玻璃管中,按如图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,记录两组数据如下表:
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37g | 玻璃管和固体物质的总质量为34.6g |
| Ⅱ 组 | 洗气瓶B和所盛溶液的总质量为180.0g | 洗气瓶B和瓶中物质的总质量为181.1g |
②应该选择______组的实验数据计算来确定红色粉末的组成.请你计算反应后固体中铁粉的质量 ( 写出计算过程 )最终计算结果表明:该红色粉末的组成是______
(3)①为了防止溶液倒吸,请判断本实验停止加热前是否需要先断开A和B的连接处并说明理由?______.
②从环保角度,上图装置有严重不足之处.你认为应该如何改进?______.

 (2012?青岛模拟)现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.
(2012?青岛模拟)现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.