题目内容
【题目】质量相等的锌和铁分别和质量相等、溶质质量分数也相等的稀盐酸反应,反应情况如图所示。则下列叙述中正确的是( )

A. 图线a、b分别表示铁、锌的反应情况
B. 锌、铁均反应完,盐酸有剩余
C. 盐酸均反应完,一定有铁剩余
D. 盐酸均反应完,一定有锌剩余
【答案】C
【解析】
A、由于在金属活动性顺序中,锌在铁前,锌的金属活动性比铁强,所以图线a、b分别表示锌、铁的反应情况,故A错误;
B、等质量金属完全反应放出氢气质量大小关系:Fe>Zn,由于得到的氢气一样多,说明稀盐酸全部参与反应,故B错误;
C、等质量金属完全反应放出氢气质量大小关系:Fe>Zn,由于得到的氢气一样多,说明稀盐酸全部参与反应,消耗的铁的质量小于锌的质量,所以这两种金属都有剩余或铁有剩余,故C正确;
D、由上述分析可知,等质量的稀盐酸消耗的锌多,又因生成的气体一样多,因此铁一定有剩余,故D错误。故选C。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】利用干燥而纯净的氢气还原氧化铜的实验测定水的质量组成。其装置如下图所示:完全反应后其实验测定的数据如下表所列(必要时装置可重复使用)。
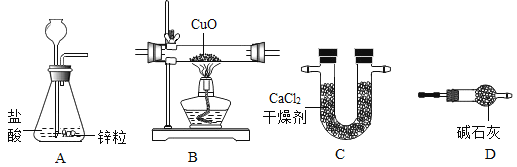
实验前 | 实验后 | |
(氧化铜+玻璃管)的质量/g | 75.6 | 69.2 |
(氯化钙+U型管)的质量/g | 100.8 | 118.0 |
试回答:
(1)A中反应容器的仪器名称是:__________。
(2)装置正确的连接顺序(自左向右)是(填字母)A-________--________--________--________。
(3)连接好装置并检查气密性装好药品后在加热前的必要操作是:________。
(4)生成水中氢元素的质量为________________________。
(5)如果没有实验装置D,实验测得水中氢的质量________(填“偏大”“偏小”或者“不变”)。
(6)本实验装置从安全角度考虑存在的缺陷是:________________________。