题目内容
【题目】自然界的水必须经过净化,才能成为饮用水。
(1)净水时,先加入适量的明矾,以_____水中悬浮的杂质;静置后过滤,然后加入_____,利用其吸附性除去异味,最后杀菌。现在推广使用ClO2消毒剂,其中Cl元素的化合价为_____。化学实验室要制备更纯净的水,可用_____ 的方法。
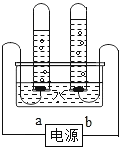
(2)电解水的反应文字表达式是_____。如图是电解水的简易装置,其中a是电源的_____(填“正”或“负”)极。若得到10 mL氢气,则同时得到_____mL氧气。电解水实验说明,水是由_____组成的。
【答案】吸附沉降 活性炭 ![]() 蒸馏 水
蒸馏 水![]() 氢气+氧气 负 5 氢元素和氧元素
氢气+氧气 负 5 氢元素和氧元素
【解析】
(1)净水时,先加入适量的明矾,明矾溶于水生成具有吸附性的物质,以吸附沉降水中悬浮的杂质。静置后过滤,然后加入活性炭,利用其吸附性除去异味,最后杀菌。现在推广使用ClO2消毒剂,由于氧显-2价,化合物中各个元素的化合价代数和为0,则Cl元素的化合价为+4。化学实验室要制备更纯净的水,可用蒸馏的方法。故答案为:吸附沉降、活性炭、![]() 、蒸馏;
、蒸馏;
(2)电解水生成了氢气和氧气,反应文字表达式是水![]() 氢气+氧气。如图是电解水的简易装置。根据正极产生的是氧气,负极产生的是氢气,氢气和氧气的体积比约为2:1可知,其中与a相连的试管收集的气体较多,是氢气,则a是电源的负极。若得到10mL氢气,则同时得到5mL氧气。电解水实验说明,水是由氢元素和氧元素组成的。故答案为:水
氢气+氧气。如图是电解水的简易装置。根据正极产生的是氧气,负极产生的是氢气,氢气和氧气的体积比约为2:1可知,其中与a相连的试管收集的气体较多,是氢气,则a是电源的负极。若得到10mL氢气,则同时得到5mL氧气。电解水实验说明,水是由氢元素和氧元素组成的。故答案为:水![]() 氢气+氧气、负、5、氢元素和氧元素。
氢气+氧气、负、5、氢元素和氧元素。

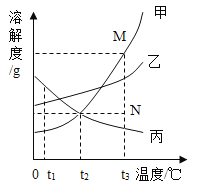
【题目】下列图象不能正确反映对应变化关系的是( )
|
|
|
|
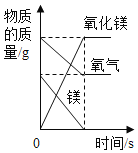
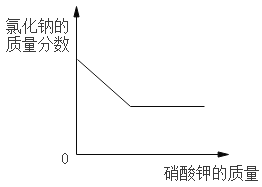
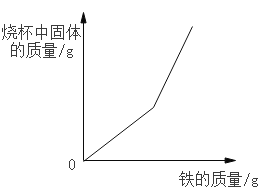
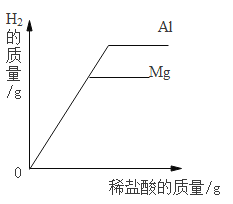
A.一定量的镁在过量的氧气中充分燃烧 | B.向 20℃时饱和氯化钠溶液中逐渐加入硝酸钾固体 | C.向盛有一定量硫酸铜溶液的烧杯中逐渐加入铁粉至过量 | D.向等质量的镁粉和铝粉中分别加入等浓度的稀盐酸至过量 |
A.AB.BC.CD.D
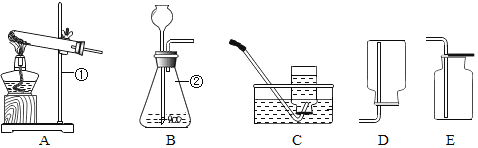
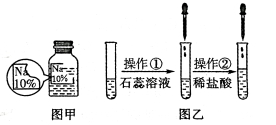
【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。