题目内容
【题目】A~F 是初中化学常见物质,它们之间的转化关系如下图所示(部分产物已略去)。
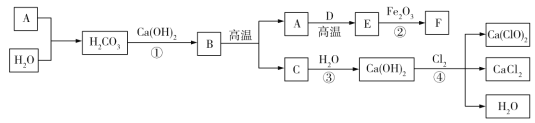
(1)写出 A 的化学式________,其常见用途为________(写一条)。
(2)反应①的化学方程式为________,该反应属于________(填基本反应类型)。
(3)反应②的现象为____________。
(4)反应③是________(填“放热”或“吸热”)反应。
(5)反应④是工业上生产漂白粉的原理,该反应的化学方程式为________。
【答案】CO2 灭火或做气体肥料或制碳酸饮料等(合理即可) H2CO3 + Ca(OH)2 = CaCO3↓+ 2H2O 复分解反应 红(棕)色粉末逐渐变成黑色粉末/ 红(棕)色粉末出现黑色物质 放热 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O
【解析】
A能与H2O反应生成碳酸,二氧化碳与水反应生成碳酸,则A为二氧化碳;碳酸与氢氧化钙反应生成碳酸钙和水,则B为碳酸钙;碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,则C为氧化钙;二氧化碳与碳在高温条件下反应生成一氧化碳,一氧化碳与氧化铁在高温条件下反应生成铁与二氧化碳,则D为碳,E为一氧化碳,F为铁。将猜想代入框图验证,猜想正确。
根据以上分析可知:
(1)写出 A 的化学式CO2,其常见用途为灭火或做气体肥料或制碳酸饮料等;
(2)反应①是碳酸与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为H2CO3 + Ca(OH)2 = CaCO3↓+ 2H2O,该反应是由两种化合物互相交换成分,生成另外两种化合物的反应,属于复分解反应;
(3)反应②是一氧化碳与氧化铁在高温条件下反应生成铁与二氧化碳,反应的现象为红(棕)色粉末逐渐变成黑色粉末/ 红(棕)色粉末出现黑色物质;
(4)反应③是氧化钙与水反应生成氢氧化钙,该反应是放热反应;
(5)反应④是工业上生产漂白粉的原理,根据流程图可知,氢氧化钙与氯气反应生成CaCl2、Ca(ClO)2和H2O,反应的化学方程式为2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O。

【题目】钙片的标签如图所示,且钙片中只有碳酸钙中含有钙元素。为测定其真实的含钙量,小东取10片钙片放入盛足量盐酸的烧杯中,充分反应后再称取烧杯和剩余物的总质量。
小东做了三次实验,数据如下表:
物质的质量/ g | 第一次 | 第二次 | 第三次 | 平均值 |
反应前:烧杯+盐酸 | 22 | 22 | 22 | 22 |
10片钙片 | 8 | 8 | 8 | 8 |
反应后:烧杯+剩余物 | 26.7 | 26.5 | 26.9 | 26.7 |
(1)请列式计算每片此钙片含碳酸钙的质量_______。
(2)请通过计算说明此标签中的含钙量是否合理_______。
【题目】氢氧化钠和氢氧化钙是两种常见的碱。李晓同学将两种碱的溶液分别装入试管A、B中,并进行了如图所示的三组实验:
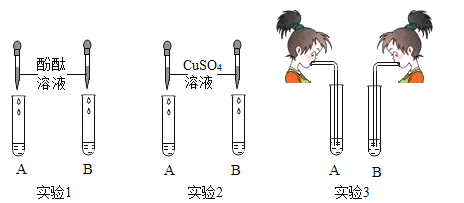
(1)实验l中,两支试管的溶液都变成______色。
(2)实验2中,若B盛装的是NaOH溶液,发生反应的化学方程式为______。
(3)实验3中,李晓同学向两支试管吹气,A中有白色沉淀生成,B中无现象,为了探究吹气后B中溶质的成分,李红进行了如下探究。
提出猜想:
猜想1:溶质只有氢氧化钠
猜想2:溶质只有碳酸钠
猜想3:溶质有氢氧化钠和碳酸钠
实验和结论:
实验 | 实验现象 | 结论 |
取B中少量溶液,加人澄清石灰水至不再产生沉淀为止,过滤后取上层清液,向其中加几滴酚酞试液。 | ______ | 猜想3成立 |
反思与评价:
老师评价李晓得出的结论不正确,是因为猜想______(填数字)也会产生相同的现象,如果要验证“猜想3成立”,必须要换试剂,将Ca(OH)2换成______溶液。