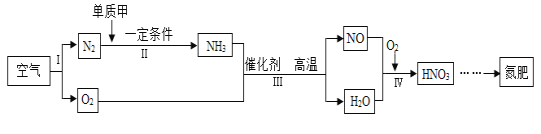
题目内容
【题目】为测定鸡蛋壳中CaCO3的质量分数,取9.0g干燥的碎鸡蛋壳放入烧杯中,向其中加入足量的稀盐酸40.0g(假设其他物质不与盐酸反应,且盐酸与水均不挥发,生成的气体全部逸出)。充分反应后烧杯中物质的总质量为46.8g。请计算:
(1)产生气体的质量是____;
(2)鸡蛋壳中CaCO3的质量分数是_____(结果保留1位小数)。
【答案】2.2g 55.6%
【解析】
根据题意,反应前后物质的总质量有差值,其原因就是碳酸钙和盐酸反应生成了二氧化碳气体。再由二氧化碳的质量,计算碳酸钙的质量。
(1)根据质量守恒定律,生成二氧化碳的质量为:9.0g+40.0g-46.8g=2.2g;
(2)解:设鸡蛋壳中碳酸钙的质量为x,
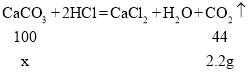
![]() ,
,
x=5.0g,
鸡蛋壳中碳酸钙的质量分数为:![]() 。
。
答:鸡蛋壳中CaCO3的质量分数为55.6%

练习册系列答案
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
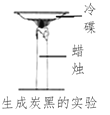
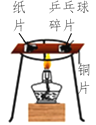
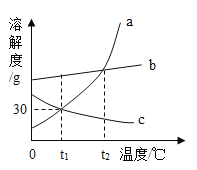
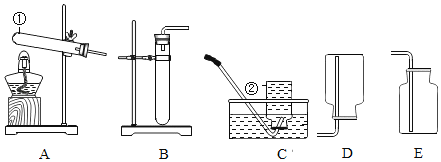
【题目】下列“课外实验”得出的结论错误的是
选项 | A | B | C | D |
课外 实验 |
|
|
|
|
实验 结论 | 说明蜡烛 含有炭黑 | 说明有些花的色素 可做酸碱指示剂 | 不同物质着火点不同 | 说明同种溶质在不同种 溶剂里溶解性不同 |
A. AB. BC. CD. D