题目内容
26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为l25.8g.求:黄铜中铜的质量分数.
解:氢气的质量=26g+100g-125.8g=0.2g.
设锌的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
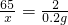
x=6.5g
黄铜中铜的质量分数: ×100%=75%
×100%=75%
答:黄铜中铜的质量分数为75%.
分析:烧杯中总物质前后减少的质量为氢气的质量,利用锌和硫酸反应的化学方程式,根据氢气的质量求出锌的质量,进而求出铜的质量,最后根据 ×100%求出黄铜中铜的质量分数.
×100%求出黄铜中铜的质量分数.
点评:利用质量守恒定律,根据反应前后质量差计算出放出氢气质量为解决问题的出发点.
设锌的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
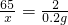
x=6.5g
黄铜中铜的质量分数:
 ×100%=75%
×100%=75%答:黄铜中铜的质量分数为75%.
分析:烧杯中总物质前后减少的质量为氢气的质量,利用锌和硫酸反应的化学方程式,根据氢气的质量求出锌的质量,进而求出铜的质量,最后根据
 ×100%求出黄铜中铜的质量分数.
×100%求出黄铜中铜的质量分数.点评:利用质量守恒定律,根据反应前后质量差计算出放出氢气质量为解决问题的出发点.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目