题目内容
【题目】将铁粉(on段)和稀硫酸(n点后)先后加入到一定量的硫酸铜溶液中,搅拌使之充分反应。过程中加入物质的质量与烧杯中剩余固体的质量关系如图所示。下列说法正确的是
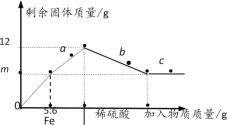
A. a、b点对应的剩余固体只有一种
B. m=6.4
C. 实验过程中共产生FeSO4的质量为15.2g
D. 取c点对应的溶液加Zn粉,产生气泡
【答案】BD
【解析】
A、a点是铁与硫酸铜还没有反应完,此时剩余固体中含有剩余的铁和生成的铜;b点是铁把硫酸铜反应完了,铁又和硫酸反应,此时铁还没有把硫酸反应完,还存在铁,所以剩余固体中含有铁和铜,故A错;
B、设5.6g铁与硫酸铜反应生成铜的质量为x,则:
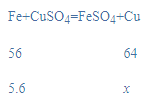
![]()
x=6.4g,所以m点含有6.4g铜,故B正确;
C、由图示可知,与硫酸铜反应的铁质量是5.6g,与硫酸铜反应完剩余的铁是:12g-6.4g=5.6g,所以反应前铁的总质量是5.6g+5.6g=11.2g,设生成硫酸亚铁的质量为y,根据:

![]()
y=30.4g,故C错;
D、c点表示加入硫酸过量,所以加Zn粉,产生氢气,产生气泡,故D正确。
故选BD。

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
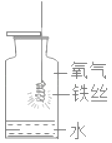
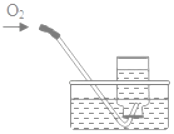
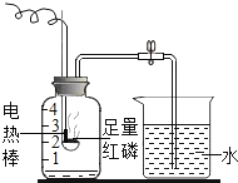
【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实验 | A | B | C | D |
装置 |
|
|
|
|
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水的体积变化得出O2的体积 | 集气瓶中的水:冷却溅落的熔融物,防止集气瓶炸裂 | 集气瓶中的水:水先将集气瓶内的空气排净,便于观察O2何时收集满 |
A. AB. BC. CD. D