题目内容
【题目】(11分)应用广泛的金属。没有金属,生活是难以想象的。请你根据所学知识回答下列问题:
(1)某炼铁厂常以焦炭、赤铁矿、空气等为主要原料炼铁,反应过程如下图所示。
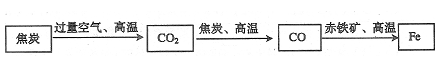
其中焦炭的作用是__________,写出碳与二氧化碳反应的化学方程式 。
(2)生产钛(Ti)的部分工艺流程图如下:
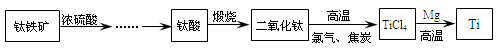
写出镁与四氯化钛(TiCl4)发生反应的化学方程式 ;该反应属于 反应(填基本反应类型名称)。上述反应需在氩气环境中进行,理由是 。
(3)将一定量的锌加入到稀硫酸、硫酸亚铁和硫酸铜的混合溶液中,反应停止后过滤,得到滤渣和滤液。向滤渣中滴加稀盐酸,有气泡产生。则滤渣中一定含有 (填化学式),滤液中一定含有的溶质是 (填化学式)。
(4)一定质量含杂质的铁(杂质不溶于水,也不参与反应)与100 g16%硫酸铜溶液恰好完全反应,过滤得到干燥的固体6.8 g,则含杂质的铁中的铁的质量分数是 (计算结果保留至0.1%)。
【答案】(1)提供热量和生成还原剂 CO2+C ![]() 2CO;
2CO;
(2)2Mg+ TiCl4=======Ti+ 2MgCl2 置换 防止高温条件下镁和钛被氧化
(3)Fe和Cu ZnSO4
(4)93.3%
【解析】
试题分析:(1)炼铁的原理是一氧化碳还原氧化铁,生成的是铁和二氧化碳,其中焦炭的作用是提供热量和生成还原剂:CO2+C ![]() 2CO;
2CO;
(2)根据反应流程可知,镁与四氯化钛反应生成的是钛和氯化镁,反应条件是高温:
2Mg+ TiCl4![]() Ti+ 2MgCl2,该反应的反应物是一种单质和一种化合物,生成物也是一种单质和一种化合物,属置换反应;氩属稀有气体,化学性质稳定,能防止高温条件下镁和钛被氧化;
Ti+ 2MgCl2,该反应的反应物是一种单质和一种化合物,生成物也是一种单质和一种化合物,属置换反应;氩属稀有气体,化学性质稳定,能防止高温条件下镁和钛被氧化;
(3)锌加入到稀硫酸、硫酸亚铁和硫酸铜的混合溶液中,锌先与硫酸反应,将硫酸反应完全后再与硫酸铜反应,最后与硫酸亚铁反应;锌与硫酸反应生成的是硫酸锌和氢气,与硫酸铜反应生成的是铜水硫酸锌,与硫酸亚铁反应生成的是铁和硫酸锌。反应后向滤渣中滴加稀盐酸,有气泡产生,说明一点含有铁和铜,可能含有锌;液中一定含有的溶质是硫酸锌;
(4)利用化学方程式,根据反应的质量比即可计算出铁的质量;
100 g16%硫酸铜溶液中溶质硫酸铜的质量= 100 g×16%=16g
设铁的质量为X,生成的铜的质量为y,
Fe + CuSO4==FeSO4+Cu
56 160 64
X 16g y
56/160=x/16g 64/160=y/16g
X=5.6g y=6.4g
那么杂质的质量=6.8g-6.4g=0.4g
含杂质的铁的质量=5.6g+0.4g=6g
铁的质量分数=5.6g/6g ×100%=93.3%
答:略

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】以下是国家关于空气污染指数与质量级别、质量状况的对应关系表
污染指数 | 50以下 | 51﹣100 | 101﹣200 | 201﹣250 | 251﹣300 | 300以上 |
质量级别 | Ⅰ | Ⅱ | Ⅲ | Ⅳ(1) | Ⅳ(2) | Ⅴ |
质量状况 | 好 | 良好 | 轻度污染 | 中度污染 | 中度重污染 | 重度污染 |
我市2011年3月12日的空气污染指数为56~76,根据上表的信息判断我市当天的空气质量级别和空气质量状况分别为( )
A.Ⅰ级 好 B.Ⅱ级 良好 C.Ⅲ级 轻度污染 D.V级 重度污染