题目内容
工业上利用太阳能进行海水晒盐.已知海水蒸发浓缩过程中析出盐的种类和质量如下表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
(1)海水从密度为1.21g?mL-1浓缩到1.22g?mL-1时发生的变化是
A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是 CaSO4、Ca2+、Mg2+.实际晒盐生产中,海水的密度一般控制在1.21g?mL-1~1.26g?mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有
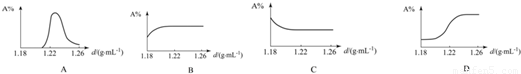
(3)如图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是

| 海水密度/(g?mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
C
C
.A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是 CaSO4、Ca2+、Mg2+.实际晒盐生产中,海水的密度一般控制在1.21g?mL-1~1.26g?mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有
Ca2+,Mg2+,SO42-;Br-
Ca2+,Mg2+,SO42-;Br-
.(3)如图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是
B
B
.
分析:(1)根据海水浓缩过程是水分减少过程,溶质不变再进一步进行分析;
(2)根据析出晶体的多少考虑;
(3)根据表中数据进行选择即可.
(2)根据析出晶体的多少考虑;
(3)根据表中数据进行选择即可.
解答:解:(1)海水浓缩过程是水分减少过程,溶质不变,溶剂减少,溶质质量分数增大,温度不变溶解度不变,所以只有C正确;
(2)由表中数据可知最先析出的是硫酸钙,因为海水密度为1.13时就已经有硫酸钙析出;海水的密度在1.21g.ml-1-1.26g.ml-1范围内,有晶体析出的都是氯化钠中的杂质,所以硫酸钙、氯化镁、硫酸镁、溴化钠都是粗盐中含有的杂质,所以所得粗盐中含有的杂质离子有:Ca2+,Mg2+,SO42-;Br-;
(3)由于浓缩过程水分减少,氯化钠的质量不变,所以氯化钠的质量分数增大,达到饱和后,由于温度不变溶解度不变,溶质质量分数不变,所以B正确.
故答案为:(1)C;(2)硫酸钙;Ca2+,Mg2+,SO42-;Br-;(3)B.
(2)由表中数据可知最先析出的是硫酸钙,因为海水密度为1.13时就已经有硫酸钙析出;海水的密度在1.21g.ml-1-1.26g.ml-1范围内,有晶体析出的都是氯化钠中的杂质,所以硫酸钙、氯化镁、硫酸镁、溴化钠都是粗盐中含有的杂质,所以所得粗盐中含有的杂质离子有:Ca2+,Mg2+,SO42-;Br-;
(3)由于浓缩过程水分减少,氯化钠的质量不变,所以氯化钠的质量分数增大,达到饱和后,由于温度不变溶解度不变,溶质质量分数不变,所以B正确.
故答案为:(1)C;(2)硫酸钙;Ca2+,Mg2+,SO42-;Br-;(3)B.
点评:解答本题关键是要知道海水浓缩过程是水分蒸发,溶质质量不变,溶解度的大小与温度有关,温度不变溶解度不变.

练习册系列答案
相关题目
工业上利用太阳能进行海水晒盐.已知海水蒸发浓缩过程中析出盐的种类和质量如下表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
| 海水密度/(g?mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是 CaSO4、Ca2+、Mg2+.实际晒盐生产中,海水的密度一般控制在1.21g?mL-1~1.26g?mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有________.
(3)下图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是________.

工业上利用太阳能进行海水晒盐.已知海水蒸发浓缩过程中析出盐的种类和质量如下表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
(1)海水从密度为1.21g?mL-1浓缩到1.22g?mL-1时发生的变化是 .
A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是 CaSO4、Ca2+、Mg2+.实际晒盐生产中,海水的密度一般控制在1.21g?mL-1~1.26g?mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有 .
(3)下图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是 .
| 海水密度/ | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
A.各种盐的溶解度增大 B.海水中水的质量分数不变
C.析出粗盐中NaCl的质量分数增大 D.海水中Br-的质量分数不变
(2)海水在浓缩过程中,最先析出的盐是 CaSO4、Ca2+、Mg2+.实际晒盐生产中,海水的密度一般控制在1.21g?mL-1~1.26g?mL-1范围内.由上表可知,所得粗盐中含有的杂质离子有 .
(3)下图能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)的关系的是 .