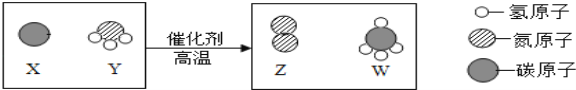
题目内容
【题目】(1)根据药品规格,若按用量服用,每天摄入钙元素的质量为_____;
(2)小明取出2片药片,研碎后放入烧杯中,加入稀盐酸,至不再产生气体为止,共用去稀盐酸50g,称量烧杯里剩余物质质量为51.56g(钙片中其它成分不与稀盐酸反应).通过计算判断钙片中碳酸钙的含量标注是否属实?______;

【答案】 0.72g 钙片中碳酸钙的含量标注不属实
【解析】(1)每天摄入钙元素的质量为:3×1×0.6g×40100×100%=0.72g;(2)生成二氧化碳的质量为:2×0.6g+50g51.56gg=0.44g,设参加反应的碳酸钙质量为![]() ,则
,则
![]()
100 44
![]() 0.44g
0.44g
![]()
![]() =1g
=1g
![]() =1g÷2=0.5g<0.6g
=1g÷2=0.5g<0.6g
所以钙片中碳酸钙的含量标注不属实。
答:(1) 每天摄入钙元素的质量为0.72g;(2) 钙片中碳酸钙的含量标注是不属实。

【题目】某同学在协助老师整理化学试剂时,发现一瓶标签残缺的无色溶液(如图所示),此溶液是什么?对此问题他进行了如下探究.
【猜想与假设】
序号 | 实验方案 | 实验现象 | 结论 |
① | 取少量该无色液体于试管中,加入______,并加热 | 若______,且加热无气泡产生 | 猜想1不正确. |
② | 向盛有少量二氧化锰的试管中加入适量的该无色液体,并将带火星的木条放在试管口 | 若试管内无气泡产生,且带火星的木条不复燃 | 猜想2________ |
③ | 向装有锌粒的试管中加入适量该无色液体,并将燃着的木条放在试管口 | 若管口有火焰,且听到“噗”的声音 | 猜想3______. |
猜想1:碳酸溶液 猜想2:过氧化氢溶液 猜想3:稀硫酸
【实验与结论】
【解释与讨论】
(1)实验③中反应的化学方程式为:___________________________;
(2)为避免出现标签被腐蚀残缺的情况,在倾倒液体时应注意___________________;