题目内容
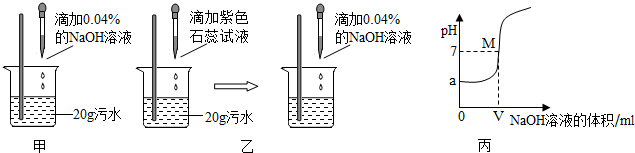
14、在甲溶液中滴加几滴石蕊试液,溶液呈蓝色;然后再滴加乙溶液,当滴至甲、乙两物质正好完全反应时,溶液呈紫色;再继续滴加乙溶液时,溶液呈红色.在上述过程中,表示溶液的pH(纵坐标)与滴加乙溶液的体积V(横坐标)之间的关系的正确图象是( )
分析:利用PH值与溶液酸碱性的关系,并结合中和反应的知识解决,抓住滴加前与恰好反应后两个关键段进行选择即可.
解答:解:石蕊遇碱变蓝,遇酸变红.故滴加前是碱的溶液PH>7,即A、B不正确;恰好反应后碱被中和掉,溶液呈中性PH=7,继续滴加变红说明酸过量PH<7,随着滴加酸性越来越强,PH值越来越小.
故选C
故选C
点评:此题考查了溶液酸碱性与PH的关系,通过图象的方式反映了酸碱中和的过程,是一道指示剂与酸碱溶液反应的新题与好题.

练习册系列答案
相关题目
 CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程.请你参与探究过程:
CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程.请你参与探究过程: (2013?松北区二模)化学课外小组的同学以“氢氧化钠变质程度”为课题,进行科学探究活动,请根据己学知识完成下列探究问题.
(2013?松北区二模)化学课外小组的同学以“氢氧化钠变质程度”为课题,进行科学探究活动,请根据己学知识完成下列探究问题.