题目内容
(2013?德阳)过氧化氢(H2O2)具有广泛的用途,医疗上可用于清理伤口,实验室可用于制取氧气等.下列有关叙述中错误的是( )
分析:A、氧化物是只含有两种元素且其中一种元素是氧元素的化合物,据此进行分析判断.
B、根据过氧化氢分子的构成进行分析判断.
C、根据过氧化氢的微观构成进行分析判断.
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
B、根据过氧化氢分子的构成进行分析判断.
C、根据过氧化氢的微观构成进行分析判断.
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
解答:解:A、过氧化氢是由氢、氧两种元素组成的化合物,属于氧化物,故选项说法正确.
B、1个过氧化氢分子是由2个氢原子和2个氧原子构成的,则过氧化氢的微观示意图可表示为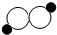 ,故选项说法正确.
,故选项说法正确.
C、过氧化氢是由过氧化氢分子构成的,1个过氧化氢分子是由2个氢原子和2个氧原子构成的,故选项说法错误.
D、过氧化氢中氢元素和氧元素的质量比为(1×2):(16×2)=1:16,故选项说法正确.
故选C.
B、1个过氧化氢分子是由2个氢原子和2个氧原子构成的,则过氧化氢的微观示意图可表示为
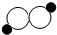 ,故选项说法正确.
,故选项说法正确.C、过氧化氢是由过氧化氢分子构成的,1个过氧化氢分子是由2个氢原子和2个氧原子构成的,故选项说法错误.
D、过氧化氢中氢元素和氧元素的质量比为(1×2):(16×2)=1:16,故选项说法正确.
故选C.
点评:本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

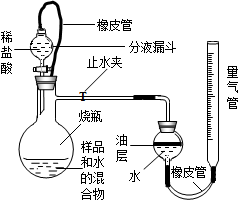 (2013?崇安区二模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气.过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究,请你参与.
(2013?崇安区二模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气.过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究,请你参与.