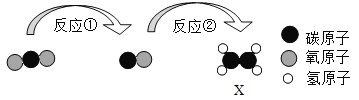
题目内容
【题目】下图所示是Ca(OH)2的部分性质实验,回答有关问题。
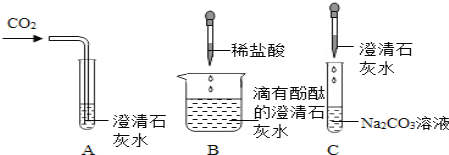
(1)B实验的化学方程式为_____________;实验C的现象是:_____________。
(2)将这三个实验后的所有物质倒入同一洁净的烧杯中,静置,观察到上层溶液为无色,底部有白色沉淀,取少量上层溶液与足量稀盐酸混合,无明显现象,综合分析可知:上层溶液中一定含有的溶质是酚酞和_____,可能含有的溶质是_______________。
【答案】2HCl+ Ca(OH)2=CaCl2+2H2O 产生白色沉淀 NaCl CaCl2
【解析】
本题是考查Ca(OH)2的部分性质实验,A图发生反应:CO2+ Ca(OH)2=CaCO3![]() +H2O ,实验现象是澄清的石灰水变浑浊;B图将稀盐酸滴入到石灰水中,发生反应:2HCl+ Ca(OH)2=CaCl2+2H2O,不确定盐酸是否过量;C图将石灰水滴入到碳酸钠溶液中,发生反应:Ca(OH)2+Na2CO3= CaCO3
+H2O ,实验现象是澄清的石灰水变浑浊;B图将稀盐酸滴入到石灰水中,发生反应:2HCl+ Ca(OH)2=CaCl2+2H2O,不确定盐酸是否过量;C图将石灰水滴入到碳酸钠溶液中,发生反应:Ca(OH)2+Na2CO3= CaCO3![]() +2NaOH。
+2NaOH。
(1)根据以上分析,B图将稀盐酸滴入到石灰水中,发生反应:2HCl+ Ca(OH)2=CaCl2+2H2O,C图将石灰水滴入到碳酸钠溶液中,发生反应:Ca(OH)2+Na2CO3= CaCO3![]() +2NaOH,有白色碳酸钙沉淀产生。
+2NaOH,有白色碳酸钙沉淀产生。
故答案为:2HCl+ Ca(OH)2=CaCl2+2H2O;产生白色沉淀。
(2)将这三个实验后的所有物质倒入同一洁净的烧杯中,静置,观察到上层溶液为无色,溶液显酸性或中性,根据以上反应方程式的分析,说明溶液中无氢氧化钙、碳酸钠和氢氧化钠(这三种物质都呈碱性,会使酚酞变红);底部有白色沉淀,可知是反应生成的碳酸钙,说明溶液中不可能有盐酸,沉淀碳酸钙会和盐酸反应,综上分析溶液中不可能有的是:氢氧化钙、盐酸、碳酸钠、氢氧化钠;溶液只能是呈中性的,只有生成的氯化钙和氯化钠是中性的,氯化钠一定会存在于溶液中,不确定氯化钙是否过量,因为钙离子与碳酸根离子可以生成碳酸钙沉淀,所以溶液中一定有氯化钠,可能有氯化钙。
故答案为:NaCl;CaCl2。

【题目】小红、小军、小明三人化学学习小组在实验中,用到了三个分别盛有KCl溶液、KOH溶液、K2SO4溶液的滴瓶。
小军发现小红将三个滴瓶中的三只滴管混用,认为小红实验不规范,滴瓶中的试剂会因此受污染而无法再次使用,学习小组就盛有KCl溶液的滴瓶是否被另外两种试剂污染进行了如下探究。
(提出问题)该滴瓶中溶质的成分是什么?
(提出猜想)通过分析,提出如下猜想:
猜想Ⅰ:溶质成分只有KCl;
猜想Ⅱ:溶质成分为KCl和KOH;
猜想Ⅲ:溶质成分为_____;
猜想Ⅳ:溶质成分为KCl、KOH和K2SO4。
(实验探究)为证明猜想,小军设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 结论或解释 |
(1)取该滴瓶内溶液少量于试管中,向试管中加入适量BaCl2溶液 | 产生白色沉淀 | 该反应的化学方程式为 _____ |
(2)将上述反应后的混合液过滤,取滤液于另一支试管中,向该试管中加入氯化铁溶液 | _____ | 证明猜想Ⅳ成立 |
(实验反思)小明认为该实验方案并未证明猜想Ⅱ、Ⅲ是否成立,应补充相应实验予以证明,你是否赞同?_____(填“是”或“否”)。
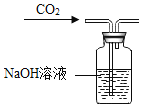
【题目】某班同学为验证碳酸钠的化学性质,向盛有碳酸钠的试管中加入一定量的稀盐酸,迅速用带导管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中(如图所示)。请回答问题:
(1)右侧试管中澄清石灰水变浑浊的化学反应方程式为________。
(2)实验结束后,将两支试管中的所有物质倒入同一个废液缸中,充分反应后得到澄清溶液。同学们对废液中溶质的成分进行如下探究(忽略二氧化碳的影响) :
[提出问题]
废液中溶质的成分是什么?
[做出猜想]
猜想一: CaCl2、NaCl和HCl
猜想二: CaCl2、NaCl和Na2CO3
猜想三:______;
[进行讨论]
经过讨论,同学们一致认为猜想________是错误的。
[设计实验]
甲同学取少量废液于试管中,向其中加入硝酸银溶液,观察到白色沉淀,甲同学得出实验结论:猜想一正确。请你评价甲同学的实验及结论________。
请帮助乙同学完成实验报告
实验步骤 | 实验现象 | 实验结论 |
取少量废液于试管中,加入_________溶液 | 溶液中先产生气泡,后产生白色沉淀 | 猜想一成立 |
[反思拓展]
最终同学们确认了废液中溶质的成分。若将废液直接排入铸铁管道,危害是_______,可以加入过量的______(写化学式)处理废液,使之达到中性后排放。