题目内容
【题目】利用食盐水制取ClO2的工业流程如图所示:
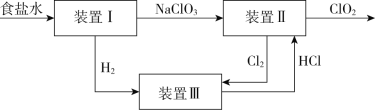
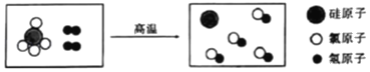
已知:装置I中发生的反应为NaCl +3H2O![]() NaClO3+3H2↑;Cl2是一种有毒气体。
NaClO3+3H2↑;Cl2是一种有毒气体。
(1)ClO2中Cl的化合价是_____。
(2)完成装置II中反应的化学方程式:2NaClO3+4HCl = 2ClO2+Cl2↑+2_____+2H2O。
(3)下列说法正确的是_____(填字母序号)。
A 装置III中H2与Cl2发生化合反应生成HCl
B 该生产过程需要消耗电能
C Cl2的循环利用可以减少生产过程对环境造成的污染
【答案】+4 NaCl ABC
【解析】
(1)ClO2中氧元素为-2价,根据化合物中正负化合价的代数和为零,设Cl元素的的化合价为x,则x+(-2)×2=0,解得x=+4,故填+4;
(2)根据反应的化学方程式“2NaClO3+4HCl = 2ClO2+Cl2↑+2_____+2H2O”和质量守恒定律可知,反应前有2个钠原子,6个氯原子,6个氧原子,4个氢原子;反应后有4个氯原子,6个氧原子,4个氢原子;缺少的2个氯原子和2个钠原子应包含在两个微粒中,所以每个微粒中含有一个钠原子和一个氯原子,所以缺少的物质的化学式为NaCl;
(3)
A、装置III中H2与Cl2发生反应生成HCl,反应符合“多变一”的特征,属于化合反应,选项正确;
B、由于装置I发生的反应需要通电,所以该生产过程需要消耗电能,选项正确;
C、由于“Cl2是一种有毒气体”,所以Cl2的循环利用可以减少生产过程对环境造成的污染,选项正确;
故填ABC。

【题目】兴趣小组获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。于是对白色粉末的化学成分进行了以下探究:
(提出猜想)
猜想1.碳酸钠;猜想2.碳酸氢钠;猜想3.碳酸钠和碳酸氢钠。
(查阅资料)
① 碳酸钠溶液、碳酸氢钠溶液均呈碱性
② 碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解。
(实验探究)
小月、小妮分别对有关猜想设计方案并进行实验:
实验操作 | 实验现象 | 实验结论 | |
小 月 | 将白色粉末溶于水后用pH试纸测定其酸碱度 | pH___(填“>”“<”或“=”)7 | 溶液呈碱性,猜想1成立 |
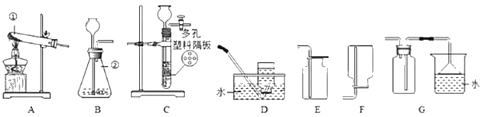
小 妮 | 用下图所示的装置进行实验 | 试管A中有___,试管B中液体____。 | 猜想2成立 |
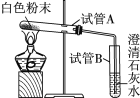
(交流反思)大家一致认为小月和小妮的结论都不准确:
(1)小月实验结论不准确的原因是____。
(2)小妮的实验方案不能排除白色粉末是否含有____。
(继续探究)小戚称取m g白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳的质量为ng,通过计算并分析实验数据确定猜想3正确,则n的取值范围为____。
(结论分析)探究后他们查到添加剂的成分是柠檬酸和碳酸氢钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
【题目】酸、碱、盐是我们身边重要的化合物,在生活和生产中具有广泛的应用。
(1)某锅炉水垢的主要成分有CaCO3、Mg(OH)2、Fe2O3,用“酸洗”法可除去该水垢。
①“酸洗”时,一般选用_____(填“稀硫酸”或“稀盐酸”);
②写出稀盐酸与氧化铁反应的化学方程式___________。
(2)两种抗胃酸药剂的主要成分及建议每次剂量见表:
主要成分 | NaHCO3 | Mg(OH)2 |
建议每次剂量/g | 0.5 | 0.3 |
每次服用Mg(OH)2的剂量比 NaHCO3“少”的原因是_____。