题目内容
向锌和碳酸钙的混合固体中加入足量的稀盐酸,共得到2.4g混合气体。将气体通过足量的澄清石灰水得到5g白色沉淀,求:
(1)混合气体中二氧化碳的质量为多少?
(2)混合固体中锌的质量分数。
(1)混合气体中二氧化碳的质量为多少?
(2)混合固体中锌的质量分数。
(1)2.2g (2)56.5%
(1)设混合气体中二氧化碳的质量为x,则
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
5g x
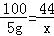 ,解得x=2.2g,
,解得x=2.2g,
答:混合气体中二氧化碳的质量为2.2g;
(2)混合气体中氢气的质量为2.4g﹣2.2g=0.2g,
设混合固体中锌的质量为y,则
Zn+2HCl═ZnCl2+H2↑
65 2
y 0.2g
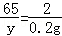 ,解得y=6.5g,
,解得y=6.5g,
则混合固体中锌的质量分数为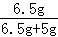 ×100%=56.5%,
×100%=56.5%,
答:混合固体中锌的质量分数为56.5%.
本题考查学生利用化学反应方程式的计算,明确发生的化学反应及利用完全反应来确定混合物的成分和质量是解答的关键.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
5g x
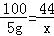 ,解得x=2.2g,
,解得x=2.2g,答:混合气体中二氧化碳的质量为2.2g;
(2)混合气体中氢气的质量为2.4g﹣2.2g=0.2g,
设混合固体中锌的质量为y,则
Zn+2HCl═ZnCl2+H2↑
65 2
y 0.2g
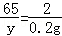 ,解得y=6.5g,
,解得y=6.5g,则混合固体中锌的质量分数为
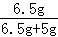 ×100%=56.5%,
×100%=56.5%,答:混合固体中锌的质量分数为56.5%.
本题考查学生利用化学反应方程式的计算,明确发生的化学反应及利用完全反应来确定混合物的成分和质量是解答的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

