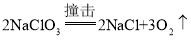题目内容
【题目】“微观——宏观——符号”三重表征是化学独特的表示物质及其变化的方法。
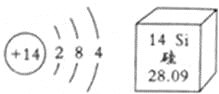
(1)如图中A 是锡元素在周期表中的信息,B、D 分别为两种粒子的结构示意图,E 为元素周期表中的部分信息,F 为某原子结构模型的示意图。请根据图中信息回答。
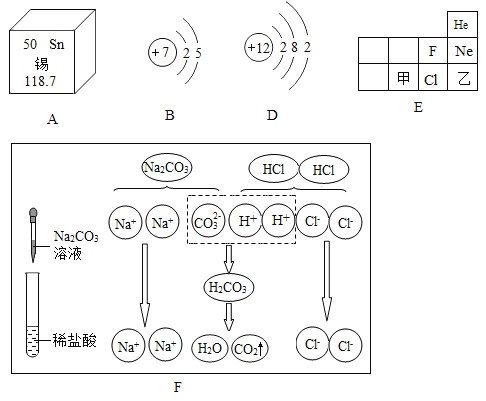
已知:质量数(相对原子质量的整数值)=质子数+中子数。
① 则某种锡原子核内中子数为_____。
② B 与D 形成的化合物的化学式为_____。
③ 元素在周期表中的分布是有规律的。E 图中乙的原子序数_____(填“大于”或“小于”)甲的原子序数。乙所代表的元素与Ne 元素的化学性质相似,其原因是_____。
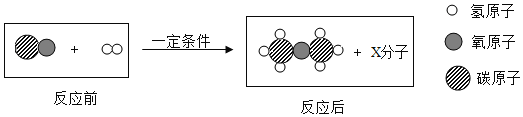
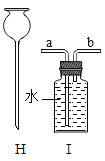
(2)从微粒的角度说明图 F 中反应的实质是_____。
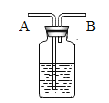
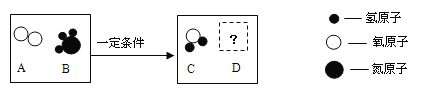
(3)经研究发现NH3 燃烧的产物没有污染。且释放大量能量,有一定应用前景,若D 为空气中体积分数最大的气体,则该反应的化学方程式为_____。
【答案】69 Mg3N2 大于 最外层电子数相同 氢离子与碳酸根离子结合生成水和二氧化碳 3O2+4NH3 6H2O+2N2
6H2O+2N2
【解析】
(1)①锡原子的质量数约为119,原子序数为50,原子中原子序数=质子数,则某种锡原子核内中子数为,119-50=69;故填:69;
②B、D的质子数分别为7和12,为氮和镁元素,氮原子的最外层电子数为5,易得到3个电子形成带3个单位负电荷的阴离子,镁原子的最外层电子数为2,易失去2个电子形成带2个单位正电荷的阳离子,化合价的数值等于离子所带电荷的数值,且符号一致,则氮元素显-3价,镁元素显+2价;B与D形成化合物为氮化镁,其化学式为:Mg3N2。故填:Mg3N2;
③ 元素在周期表中的分布是有规律的。E 图中乙的原子序数大于甲的原子序数。乙所代表的元素与Ne元素的化学性质相似,其原因是最外层电子数相同。故填:大于;最外层电子数相同;
(2)从图可以看出该反应的实质是氢离子和碳酸根离子结合生成水分子和二氧化碳分子;故填:氢离子与碳酸根离子结合生成水和二氧化碳;
(3)由在一定条件下,A、B 能发生化学反应生成 C 和 D,其微观示意图可知,A为氧气,B为氨气,C为水,若 D 为空气中体积分数最大的气体,则D是氮气,则该反应的化学方程式:3O2+4NH3 6H2O+2N2。故填:3O2+4NH3
6H2O+2N2。故填:3O2+4NH3 6H2O+2N2。
6H2O+2N2。

 高中必刷题系列答案
高中必刷题系列答案