题目内容
【题目】在烧杯中加入7.31g的表面氧化的锌片,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示。请回答下列问题:
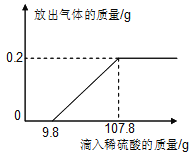
(1)产生氢气的质量是 g。
(2)所滴加的稀硫酸中溶质的质量分数。
(3)锌片恰好完全反应时,溶液中溶质的质量。
【答案】(1)0.2 (2)10% (3)17.71g
【解析】
试题分析:
(1)由反应法关系图可知,生成的氢气的质量为0.2g;
(2)锌与稀硫酸反应生成的硫酸锌和氢气,根据反应的关系图可知与锌反应消耗的稀硫酸的质量=107.8g-9.8g=98g;利用化学方程式,根据硫酸与氢气反应的质量比即可计算出稀硫酸中溶质的质量;
设稀硫酸中溶质的质量为x,生成的硫酸锌的质量为y,
Zn+H2SO4==ZnSO4+H2↑
98 161 2
X y 0.2g
98/2 =x/0.2g 161/2 =y/0.2g
X=9.8g y=16.1g
所滴加的稀硫酸中溶质的质量分数=9.8g/98g ×100% =10% ;
(3)锌与氧气反应生成的是氧化锌,氧化锌与稀硫酸反应生成的是硫酸锌和水,由反应的关系图可知氧化锌消耗的稀硫酸的质量为9.8g,溶质硫酸的质量=9.8g×10%=0. 98g,利用化学方程式,根据硫酸锌与硫酸反应的质量比即可计算出生成的硫酸锌的质量;
设生成的硫酸锌的质量为z,
ZnO+H2SO4==ZnSO4+H2O
98 161
0.98g z
98/0. 98g=161/z
Z=1.61g
那么反应后溶液中溶质硫酸锌的质量=1.61g+16.1g=17.71g

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目