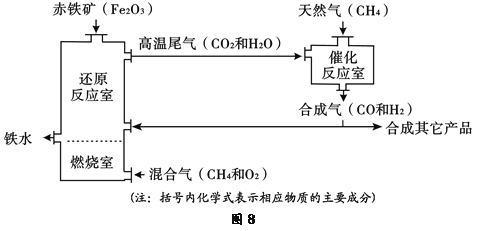
题目内容
【题目】某课外活动小组利用稀硫酸测定粗锌中纯锌的含量。现称取粗锌20g,加入到足量硫酸溶液中充分反应(杂质不参与反应),测得数据如下表:
时间/min | 0 | 3 | 6 | 9 |
粗锌及溶液总质量/g | 150.4 | 150.2 | 150.0 | 150.0 |
(1)计算反应过程中产生氢气的质量。
(2)根据表中数据计算粗锌中锌的质量分数。
【答案】解:(1)0.4g
(2)65%
【解析】试题分析:根据题意书写反应的化学方程式Zn+H2SO4=ZnSO4+H2↑,由于该反应有气体生成,结合质量守恒定律可知,反应前后粗锌及溶液总质量会减小,且减少的质量即为氢气的质量,而后利用锌与硫酸反应的化学方程式,根据氢气的质量求出锌的质量,最后可求出粗锌中锌的质量分数。
根据表格可知,到6分钟以后,粗锌及溶液总质量不再改变,说明已完全反应,由此可知,反应生成的氢气的质量为150.4g-150.0g=0.4g。
设20g粗锌中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.4g
65:x=2:0.4g
解得x=13g
则粗锌中锌的质量分数=![]() ×100%=65%
×100%=65%

练习册系列答案
相关题目