题目内容
镁是一种:
①银白色金属;
②质软;
③具有良好的导电性和传热性.镁是一种活动性较强的金属;
④在空气中很容易氧化,使得表面变黑;
⑤镁在空气中点燃能剧烈燃烧,发出耀眼白光;
⑥军事上利用镁的这一性质来制造照明弹;
⑦镁还能跟酸快速反应,生成氢气;
⑧工业上用电解熔融氯化镁的方法制取镁.
根据以上信息回答:
(1)以上叙述中,属于镁的物理性质有(填序号)
(2)镁在空气中燃烧的现象是:
(3)镁于盐酸反应的现象有:
①银白色金属;
②质软;
③具有良好的导电性和传热性.镁是一种活动性较强的金属;
④在空气中很容易氧化,使得表面变黑;
⑤镁在空气中点燃能剧烈燃烧,发出耀眼白光;
⑥军事上利用镁的这一性质来制造照明弹;
⑦镁还能跟酸快速反应,生成氢气;
⑧工业上用电解熔融氯化镁的方法制取镁.
根据以上信息回答:
(1)以上叙述中,属于镁的物理性质有(填序号)
①②③
①②③
;属于镁的化学性质的有④⑤⑦
④⑤⑦
.(2)镁在空气中燃烧的现象是:
剧烈燃烧
剧烈燃烧
、发出耀眼白光
发出耀眼白光
、生成白色粉末状固体
生成白色粉末状固体
、放出热量
放出热量
.反应的文字表达式为镁+氧气
氧化镁
| 点燃 |
镁+氧气
氧化镁
.| 点燃 |
(3)镁于盐酸反应的现象有:
镁的表面有气泡产生
镁的表面有气泡产生
、镁在不断减少
镁在不断减少
、放出热量
放出热量
.反应的文字表达式为镁+盐酸→氯化镁+氢气
镁+盐酸→氯化镁+氢气
.分析:(1)物理性质是指物质不需要发生化学变化就表现出来的性质.化学性质是指物质在化学变化中表现出来的性质.而化学变化的本质特征是变化中有新物质生成,因此,判断物理性质还是化学性质的关键就是看表现物质的性质时是否有新物质产生;
(2)根据镁条燃烧的现象回答,熟悉文字表达式的写法;
(3)根据镁与盐酸反应的生成物考虑反应现象,根据文字表达式的写法写出文字表达式.
(2)根据镁条燃烧的现象回答,熟悉文字表达式的写法;
(3)根据镁与盐酸反应的生成物考虑反应现象,根据文字表达式的写法写出文字表达式.
解答:解:(1)物质的颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性、导电性、导热性等性质,不需要发生化学变化就表现出来,因此,都属于物理性质;①银白色金属属于物质的颜色属于物理性质;②质软属于物质的硬度属于物理性质;③具有良好的导电性和传热性.属于物质的导电性、导热性属于物理性质;④在空气中很容易氧化,使得表面变黑发生了化学变化,生成氧化镁,属于化学性质;⑤镁在空气中点燃能剧烈燃烧,发出耀眼白光,是通过镁燃烧生成氧化镁表现出来的,属于化学性质,⑦镁还能跟酸快速反应,生成氢气,是通过化学变化表现出来的,属于化学性质;
(2)镁在空气中燃烧的现象是剧烈燃烧,发出耀眼白光,生成白色粉末状固体,放出热量;反应物是镁和氧气,生成物是氧化镁,所以文字表达式是:镁+氧气
氧化镁;
(3)镁与盐酸反应生成氯化镁和氢气,所以镁的表面有气泡产生,镁在不断减少,放出热量;反应物是镁和盐酸,生成物是氯化镁和氢气,所以文字表达式是:镁+盐酸→氯化镁+氢气.
故答案为:(1)①②③;④⑤⑦;
(2)剧烈燃烧;发出耀眼白光;生成白色粉末状固体;放出热量;镁+氧气
氧化镁;
(3)镁的表面有气泡产生;镁在不断减少;放出热量;镁+盐酸→氯化镁+氢气.
(2)镁在空气中燃烧的现象是剧烈燃烧,发出耀眼白光,生成白色粉末状固体,放出热量;反应物是镁和氧气,生成物是氧化镁,所以文字表达式是:镁+氧气
| 点燃 |
(3)镁与盐酸反应生成氯化镁和氢气,所以镁的表面有气泡产生,镁在不断减少,放出热量;反应物是镁和盐酸,生成物是氯化镁和氢气,所以文字表达式是:镁+盐酸→氯化镁+氢气.
故答案为:(1)①②③;④⑤⑦;
(2)剧烈燃烧;发出耀眼白光;生成白色粉末状固体;放出热量;镁+氧气
| 点燃 |
(3)镁的表面有气泡产生;镁在不断减少;放出热量;镁+盐酸→氯化镁+氢气.
点评:物理性质、化学性质是一对与物理变化、化学变化有密切关系的概念,联系物理变化、化学变化来理解物理性质和化学性质,则掌握起来并不困难,熟悉文字表达式的写法,反应现象的叙述方法.

练习册系列答案
相关题目
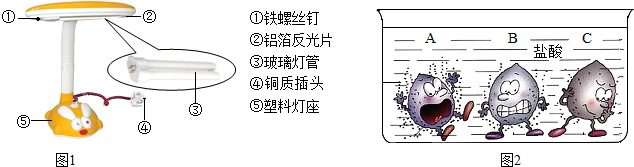


 ①右图所示的台灯,序号标示的物质中属于金属材料的有 ▲ (填序号);小明发现台灯的铁螺丝钉表面已经锈蚀,原因是铁与空气中的氧气及 ▲ 等发生了化学反应。
①右图所示的台灯,序号标示的物质中属于金属材料的有 ▲ (填序号);小明发现台灯的铁螺丝钉表面已经锈蚀,原因是铁与空气中的氧气及 ▲ 等发生了化学反应。 ①A、B、C三种金属的活动性由强到弱的顺序是
①A、B、C三种金属的活动性由强到弱的顺序是
 ①右图所示的台灯,序号标示的物质中属于金属材料的有 ▲ (填序号);小明发现台灯的铁螺丝钉表面已经锈蚀,原因是铁与空气中的氧气及 ▲ 等发生了化学反应。
①右图所示的台灯,序号标示的物质中属于金属材料的有 ▲ (填序号);小明发现台灯的铁螺丝钉表面已经锈蚀,原因是铁与空气中的氧气及 ▲ 等发生了化学反应。 ①A、B、C三种金属的活动性由强到弱的顺序是
①A、B、C三种金属的活动性由强到弱的顺序是