题目内容
【题目】某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验.他们设计了如下方案: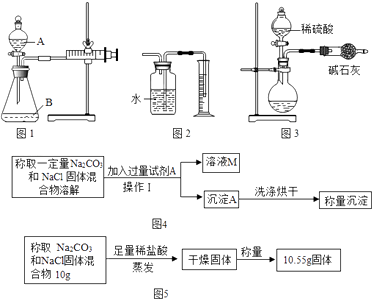
(1)方案一:气体分析法.
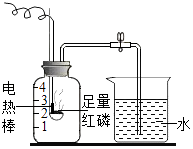
(i)如图1所示(铁夹夹持的仪器是注射器),把该混合物与足量稀硫酸反应后,测定产生CO2的体积,检查该装置的气密性的方法是 .
(ii)有同学提出以图2代替图1中的收集装置,则所测CO2气体的体积(填“偏大”、“偏小”或“不变”),理由是 , 广口瓶内原有的空气对实验结果(填“有”或“没有”)影响.
(iii)有同学用图3装置进行测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物).
该装置导致实验结果偏大的可能原因是
A、装置内残留的CO2气体不能全部排出.
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收.
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收.
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O.
(2)方案二:沉淀分析法 (如图4所示).则:
(i)确定CaCl2溶液是否过量的方法是 .
(ii)该方法发生反应的化学方程式为 .
(3)方案三:盐酸滴定法(如图5所示)
(i)用已知浓度盐酸滴加到一定质量的混合物,根据消耗盐酸溶液的体积来测定碳酸钠的含量,在实验过程中判断斥所滴加的稀盐酸恰好与碳酸钠反应的方法是 .
(ii)晓红同学通过实验测定了一些数据,试根据下面的实验数据计算Na2CO3的质量分数.称取Na2CO3和NaaCl固体混合物10g,与足量稀盐酸反应后蒸发干燥得到10.55g固体.该
固体混合物中Na2CO3质量分数为 .
【答案】
(1)将注射器活塞拉出一定距离,一段时间后松开活塞,活塞能回到原位则不漏气;偏小;CO2能溶于水且与水反应;没有;BCD
(2)静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2溶液已过量;Na2CO3+CaCl2=CaCO3↓+2NaCl
(3)直到不再生成气泡为止;53%
【解析】解:【方案一】(i)若装置漏气,拉出的活塞不移动,若不漏气,拉出的活塞在大气压强的作用下应回到原来的位置;(ii)因为二氧化碳不仅能溶于水还能与水反应,用排水法收集气体,收集的二氧化碳偏小,该气体排开水的体积即为测量的气体体积,故原广口瓶中的气体对测量的结果没有影响;(iii)A、装置内残留的CO2气体不能全部排出,导致碱石灰增加的质量偏小,实验结果偏小,故A错误;
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收,导致碱石灰增加的质量偏大,实验结果偏大,故B正确;
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收,导致碱石灰增加的质量偏大,实验结果偏大,故B正确;
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O,导致碱石灰增加的质量偏大,实验结果偏大,故B正确;
故选:BCD;
【方案二】(i)判断是否过量,主要看溶液中是否还有CO32﹣ , 因此将溶液静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2溶液已过量;(ii)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;【方案三】(i)盐酸滴加到溶液中会与碳酸钠反应生成二氧化碳气泡这一现象非常明显;
(ii)设参加反应的Na2CO3的质量为x,
Na2CO3+ | 2HCl | = | 2NaCl+ | H2O+CO2↑ | 固体质量增加 |
106 | 117 | ||||
x | 0.55g |
![]()
x=5.3g
所以Na2CO3的质量分数为: ![]() ×100%=53%.
×100%=53%.
所以答案是:(1)【方案一】(i)将注射器活塞拉出一定距离,一段时间后松开活塞,活塞能回到原位则不漏气;(ii)偏小,CO2能溶于水且与水反应,没有;(iii)BCD;(2)【方案二】(i)静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2溶液已过量;(ii)Na2CO3+CaCl2=CaCO3↓+2NaCl;(3)【方案三】(i)直到不再生成气泡为止;(ii)53%.
【考点精析】利用检查装置的气密性和书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知装置气密性检查:先将导管的一端浸入水中,用手紧贴容器外壁,稍停片刻,若导管口有气泡冒出,松开手掌,导管口部有水柱上升,稍停片刻,水柱并不回落,就说明装置不漏气;注意:a、配平 b、条件 c、箭号.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案【题目】右图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种.某同学对①、②、③、④处水质监测时记录了以下现象.根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是( )
① | ② | ③ | ④ | |
记录现象 | 无色溶液 | 蓝色浑浊 | 浑浊消失 | 产生气泡 |
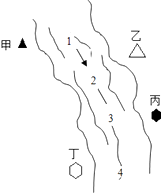
A.甲:碳酸钠
B.乙:氯化铜
C.丙:盐酸
D.丁:碳酸钠