题目内容
实验室里有两瓶无色液体,一瓶是硬水,一瓶是软水,但是由于现在标签模糊,请你帮忙鉴别这两瓶液体.并写下你的实验过程.实验操作 | 实验现象 | 实验结论 |
【答案】分析:根据硬软水一般采用肥皂水区分进行解答.
解答:解:软硬水才用肥皂水检验即可.
故答案为:
点评:此题是借助对物质的检验进行的实验探究,涉及到软硬水的知识,并结合了硬水转化的相关知识.
解答:解:软硬水才用肥皂水检验即可.
故答案为:
| 实验操作 | 实验现象 | 实验结论 |
| 取两种无色液体少量于2只试管中,分别加入少量肥皂水,振荡 | 一支试管中出现较多泡沫;一支试管中出现较少的泡沫 | 出现较多泡沫是软水,出现较少的泡沫是硬水 |
点评:此题是借助对物质的检验进行的实验探究,涉及到软硬水的知识,并结合了硬水转化的相关知识.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
实验室里有一瓶标签残缺的盐酸,请你来共同探究.
(1)
怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是,大家各抒己见.你认为,应该用下述的______方法(填选项编号)立即确认.|
A .讨论 |
B .调查 |
C .实验 |
D .上网 |
具体的做法是
__________________________________________.(2)
粗略测定每毫升该盐酸中含溶质HCl的质量.同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:第
1步:在小烧杯中加入10g5%的NaOH溶液;第
2步:向上述烧杯中滴入2滴酚酞溶液;第
3步:向100mL量筒中注入该盐酸至一定刻度;第
4步:用胶头滴管吸取量筒中的盐酸.逐滴滴入上述烧杯中,直到烧杯中的溶液由红色变为无色为止;第
5步:记录实验数据;第
6步:计算,确定每毫升盐酸中含溶质HCl的质量.请根据以上实验过程,回答下列问题:
①本实验为什么要用指示剂
(酚酞)?答:
_______________________________________________.②第
3步中向量筒注入盐酸,量筒中的液面位置如图所示,A与B、B与C刻度间均相差1mL,如果刻度A为8,量筒中盐酸的体积是______mL.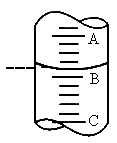
③第
4步要用到玻璃棒,它的作用是______,目的是___________.停止滴入盐酸后,胶头滴管中残留的盐酸应
________________________.④第
5步要记录的实验数据是___________________________________.(3)
测定每毫升该盐酸中含溶质HCl的质量,其原理和方法还有多种,为此大家继续进行探究.你能写出两种其他可行的方法吗?若能,请写在下面(用文字简述所依据的原理和要测定的数据,不需要写出化学方程式).方法一:
_____________________________________方法二:
_____________________________________ (2012?黄冈)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如右图所示)的无色溶液,他们对此产生了兴趣.
(2012?黄冈)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如右图所示)的无色溶液,他们对此产生了兴趣.