题目内容
【题目】往100gFeCl3和CuCl2的混合溶液中加入铁粉。已知FeCl3会先与铁粉发生反应:2FeCl3+Fe=3FeCl2。下图为加入铁粉的质量与反应后剩余固体的质量关系。下列说法不正确的是( )
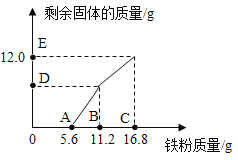
A.D点对应纵坐标为6.4
B.B点后溶液的颜色为蓝色
C.该100g溶液中的CuCl2的质量分数为13.5%
D.取DE两点间(不含D)的剩余固体加入盐酸,均有气泡产生
【答案】B
【解析】
A、B点处与氯化铜反应铁的质量为11.2g-5.6g=5.6g,设生成铜的质量为y,计算过程如下:
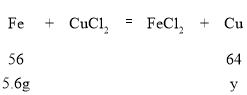
![]() ,解得y=6.4g,剩余的固体铜的质量为6.4g,故D点对应的纵坐标为6.4,正确;
,解得y=6.4g,剩余的固体铜的质量为6.4g,故D点对应的纵坐标为6.4,正确;
B、A点以前是铁与氯化铁反应,说明与氯化铁反应的铁为5.6g;A-B段是铁与氯化铜溶液反应,B点后溶液中无氯化铜,错误;
C、5.6~11.2段是铁与氯化铜反应,消耗铁粉的质量为5.6g,设氯化铜的质量为x,计算过程如下:
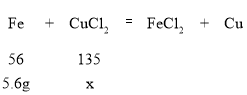 ,
,
![]() ,解得x=13.5g,原溶液质量为100g,所以氯化铜质量分数为
,解得x=13.5g,原溶液质量为100g,所以氯化铜质量分数为![]() =13.5%,正确;
=13.5%,正确;
D、m(剩余固体)>6.4g时,2FeCl3+Fe═3FeCl2进行完,反应 CuCl2+Fe═FeCl2+Cu正在进行,剩余固体的成分是Cu和Fe;此剩余固体加入盐酸,发生反应的化学方程式为:Fe+2HCl═FeCl2+H2↑;均有气泡产生,正确。
故选B。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目