题目内容
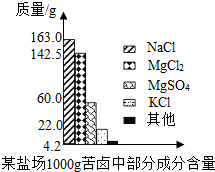 海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.下图是我市某盐场苦卤中部分成分含量柱形图.试计算:
海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.下图是我市某盐场苦卤中部分成分含量柱形图.试计算:(1)若使100 g该苦卤中的MgCl2和MgSO4完全转化为Mg(OH)2沉淀,需要20% NaOH溶液多少克?
(2)将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为3.0 g/L)?
分析:(1)由柱状图可以知道100g苦卤中氯化镁和硫酸镁的质量;
由氯化镁和硫酸镁的质量根据与氢氧化钠反应的化学方程式可以计算出分别需要氢氧化钠的质量和需要氢氧化钠的总质量及分别生成氢氧化镁的质量和生成氢氧化镁的总质量;
由氢氧化钠的总质量根据氢氧化钠溶液的溶质质量分数可以计算出所需氢氧化钠溶液的质量.
(2)由氢氧化镁的质量根据与稀盐酸反应的化学方程式可以得到氯化镁的质量,进而得到金属镁的质量,结合氯气的密度可以得到氯气的体积.
由氯化镁和硫酸镁的质量根据与氢氧化钠反应的化学方程式可以计算出分别需要氢氧化钠的质量和需要氢氧化钠的总质量及分别生成氢氧化镁的质量和生成氢氧化镁的总质量;
由氢氧化钠的总质量根据氢氧化钠溶液的溶质质量分数可以计算出所需氢氧化钠溶液的质量.
(2)由氢氧化镁的质量根据与稀盐酸反应的化学方程式可以得到氯化镁的质量,进而得到金属镁的质量,结合氯气的密度可以得到氯气的体积.
解答:解:(1)根据柱状图可知100g苦卤中氯化镁的质量为
142.5g×
=14.25g
设将氯化镁转化为氢氧化镁需要氢氧化钠的质量为x,生成氢氧化镁的质量为y.
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 80 58
14.25g x y
=
=
,x=12g,y=8.7g
根据柱状图可知100g苦卤中硫酸镁的质量为
60g×
=6g
设将硫酸镁转化为氢氧化镁需要氢氧化钠的质量为z,生成氢氧化镁的质量为w.
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 80 58
6g z w
=
=
,z=4g,w=2.9g
共需要氢氧化钠溶液的质量为
(12g+4g)÷20%=80g
(2)共生成氢氧化镁沉淀的质量为
8.7g+2.9g=11.6g
设生成金属镁的质量为m,生成氯气的质量为n.
由Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2
Mg+Cl2↑得
Mg(OH)2→MgCl2→Mg+Cl2↑
58 24 71
11.6g m n
=
=
,m=4.8g,n=14.2g
氯气的体积为
14.2g÷3.0g/L≈4.7L
答:(1)需要20%的氢氧化钠溶液80g.
(2)可得金属镁4.8g,氯气4.7L.
142.5g×
| 100g |
| 1000g |
设将氯化镁转化为氢氧化镁需要氢氧化钠的质量为x,生成氢氧化镁的质量为y.
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 80 58
14.25g x y
| 95 |
| 14.25g |
| 80 |
| x |
| 58 |
| y |
根据柱状图可知100g苦卤中硫酸镁的质量为
60g×
| 100g |
| 1000g |
设将硫酸镁转化为氢氧化镁需要氢氧化钠的质量为z,生成氢氧化镁的质量为w.
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 80 58
6g z w
| 120 |
| 6g |
| 80 |
| z |
| 58 |
| w |
共需要氢氧化钠溶液的质量为
(12g+4g)÷20%=80g
(2)共生成氢氧化镁沉淀的质量为
8.7g+2.9g=11.6g
设生成金属镁的质量为m,生成氯气的质量为n.
由Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2
| ||
Mg(OH)2→MgCl2→Mg+Cl2↑
58 24 71
11.6g m n
| 58 |
| 11.6g |
| 24 |
| m |
| 71 |
| n |
氯气的体积为
14.2g÷3.0g/L≈4.7L
答:(1)需要20%的氢氧化钠溶液80g.
(2)可得金属镁4.8g,氯气4.7L.
点评:本题主要考查有关化学方程式的计算,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.如图是某盐场苦卤中部分成分含量柱形图.试计算:
海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.如图是某盐场苦卤中部分成分含量柱形图.试计算:

 (2)将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为3.0 g/L)?
(2)将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为3.0 g/L)?