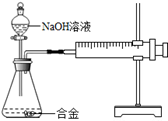
题目内容
晓敏同学对餐桌上加热食物的某种白色固体燃料产生了浓厚的兴趣,于是她进行了以下探究活动。请你一起参与她的探究过程吧!
【猜 想 一】 固体燃料是固态的酒精吗?
【资 料 一】 酒精,学名乙醇,熔点为-114.1℃,沸点为78.5℃,易溶于水,能与水以任意比互溶。
【得出结论1】根据资料一,你认为常温下酒精的状态是 。
【提出问题】 固体燃料可能含有哪些元素?
【资 料 二】
① CuSO4 + 5H2O = CuSO4·5H2O
无水硫酸铜是白色固体 五水合硫酸铜是蓝色固体
NaOH溶液可以用来充分吸收二氧化碳气体。
2NaOH + CO2 = Na2CO3 + H2O
【得出结论2】根据资料二,白色的无水硫酸铜遇到水变成 色。
【实验探究】
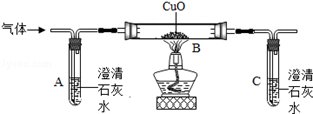
如下图所示,晓敏同学取适量固体燃料置于某装置中,用火柴点燃,并将燃烧产生的气体依次通过以下装置。固体燃料燃烧后,有少量固体残余。
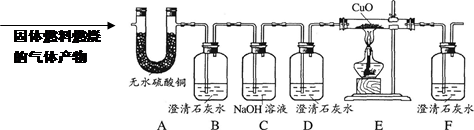
【实验现象】
①A中白色固体部分变蓝,说明燃烧的生成物中有 ,可知固体燃料中一定含有 元素。
②B中澄清石灰水变浑浊,说明燃烧的生成物中有二氧化碳,写出B中发生反应的化学方程式 。可知固体燃料中一定含有 元素。
③C、D中无明显变化,说明燃烧生成的二氧化碳已被完全吸收。
④E中黑色的氧化铜逐渐变红,F中澄清石灰水变浑浊, 说明燃烧的生成物中还含有的物质是 。
【实验结论3】根据以上实验事实,晓敏认为该白色固体燃料中肯定含有氧元素。你认为晓敏的判断是否合理 ,理由是
。
【猜 想 一】 固体燃料是固态的酒精吗?
【资 料 一】 酒精,学名乙醇,熔点为-114.1℃,沸点为78.5℃,易溶于水,能与水以任意比互溶。
【得出结论1】根据资料一,你认为常温下酒精的状态是 。
【提出问题】 固体燃料可能含有哪些元素?
【资 料 二】
① CuSO4 + 5H2O = CuSO4·5H2O
无水硫酸铜是白色固体 五水合硫酸铜是蓝色固体
NaOH溶液可以用来充分吸收二氧化碳气体。
2NaOH + CO2 = Na2CO3 + H2O
【得出结论2】根据资料二,白色的无水硫酸铜遇到水变成 色。
【实验探究】
如下图所示,晓敏同学取适量固体燃料置于某装置中,用火柴点燃,并将燃烧产生的气体依次通过以下装置。固体燃料燃烧后,有少量固体残余。

【实验现象】
①A中白色固体部分变蓝,说明燃烧的生成物中有 ,可知固体燃料中一定含有 元素。
②B中澄清石灰水变浑浊,说明燃烧的生成物中有二氧化碳,写出B中发生反应的化学方程式 。可知固体燃料中一定含有 元素。
③C、D中无明显变化,说明燃烧生成的二氧化碳已被完全吸收。
④E中黑色的氧化铜逐渐变红,F中澄清石灰水变浑浊, 说明燃烧的生成物中还含有的物质是 。
【实验结论3】根据以上实验事实,晓敏认为该白色固体燃料中肯定含有氧元素。你认为晓敏的判断是否合理 ,理由是
。
结论1:液态 ;结论2:蓝 ;①水 ; 氢元素(或H)②Ca(OH)2 + CO2 = CaCO3 ↓ + H2O ; 碳元素(或C) ④ 一氧化碳(或CO)结论3:否 ;燃烧时氧气参加了反应,提供了氧元素,所以不能肯定该白色固体燃料组成中是否含有氧元素。(答案合理即可)
试题分析:【得出结论1】根据资料一,你认为常温下酒精的状态是液态;【得出结论2】根据资料二,白色的无水硫酸铜遇到水变成蓝色;①A中白色固体部分变蓝,说明燃烧的生成物中有水;可知固体燃料中一定含有氢元素;②B中澄清石灰水变浑浊,说明燃烧的生成物中有二氧化碳,B中发生反应的化学方程式为Ca(OH)2 + CO2 = CaCO3 ↓ + H2O ;可知固体燃料中一定含有碳元素;④ E中黑色的氧化铜逐渐变红,F中澄清石灰水变浑浊, 说明燃烧的生成物中还含有的物质是一氧化碳【实验结论3】根据以上实验事实,晓敏认为该白色固体燃料中肯定含有氧元素。你认为晓敏的判断否合理,理由是燃烧时氧气参加了反应,提供了氧元素,所以不能肯定该白色固体燃料组成中是否含有氧元素。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目