题目内容
(2013福建厦门)某化学兴趣小组回收利用废旧干电池。
实验 1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可于水。兴趣小组的同学们设计回收物质的流程如图 1所示。
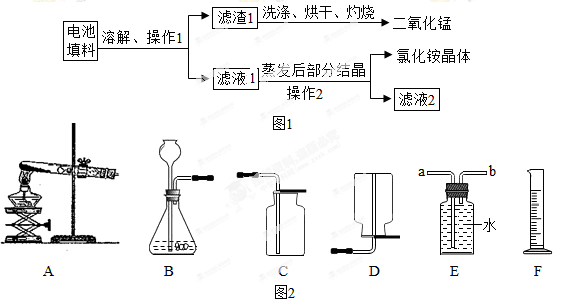
(1)操作1 和操作2 的名称都是____________,该操作中玻璃棒的作用是____________。
(2)灼烧滤渣 l 的目的是________________________ 。
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度____氯化锌的溶解度(填“<”、“=”或“>”)。
实验 2 利用外壳回收物锌制取氢气及相关探究
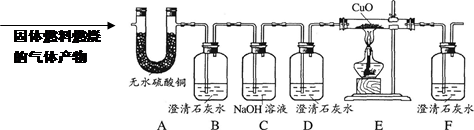
(4)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
①应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
②若用排水法收集并测定气体的体积,气体从装置B导管口____(填“ a ”或“ b ” ) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是________。
(5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
①比较实验 a 和实验 b ,可以得到的结论是________________________。
②为了研究硫酸浓度对反应快慢的影响,需比较实验_____和实验_____(填编号)。
③控制其他条件相同,需控制的条件是______________________(例举一种条件即可)。
实验 1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可于水。兴趣小组的同学们设计回收物质的流程如图 1所示。

(1)操作1 和操作2 的名称都是____________,该操作中玻璃棒的作用是____________。
(2)灼烧滤渣 l 的目的是________________________ 。
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度____氯化锌的溶解度(填“<”、“=”或“>”)。
实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
①应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
②若用排水法收集并测定气体的体积,气体从装置B导管口____(填“ a ”或“ b ” ) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是________。
(5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 | 试剂 | 前10 min内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30 mL 30 % | 564.3 |
| b | 含杂质的锌 | 30 InL 30 % | 634.7 |
| c | 纯锌 | 30 mL 20 % | 449.3 |
| d | 纯锌 | 40 mL 30 % | 602.8 |
②为了研究硫酸浓度对反应快慢的影响,需比较实验_____和实验_____(填编号)。
③控制其他条件相同,需控制的条件是______________________(例举一种条件即可)。
(1)过滤,引流 (2) 除去炭粉 (3) < (4) ① B, D。 ②b,量筒
(5)①与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率要快 ② a和c ③锌粒形状大小
(5)①与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率要快 ② a和c ③锌粒形状大小
试题分析:实验1:操作1和操作2之后得到了滤渣和滤液,故操作1为过滤,过滤操作中玻璃棒起引流的作用.通过灼烧可以使炭粉转化为CO2,在一定温度下氯化铵溶解度小于氯化锌的溶解度,故大量的氢化铵晶体先析出.
实验2:初中化学中有2套气体的发生装置,分别为固固加热型制取气体、固液不需要加热型制取气体,选择的依据是反应条件和反应物的状态。实验室用锌和稀硫酸制取氢气,故应该选择固液不需要加热型制取气体的装置;比较实验a和实验b可以发现,稀硫酸浓度相同,只是a实验中为纯锌,实验中为含杂质的锌导致前10 min内产生的氢气体积不同,故得出与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率要快,为了研宄硫酸浓度对反应快慢的影响,需要控制锌的纯度相同,稀硫酸的体积相同,让稀硫酸的浓度成为唯一的一个变量.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目

 三位同学利用电子天平共同作了以下测定实验,并记录如下实验数据。
三位同学利用电子天平共同作了以下测定实验,并记录如下实验数据。