题目内容
【题目】取锌、铜的混合物8g与154.7g稀硫酸恰好完全反应,称得剩余物质的总质量为162.5g。请计算:
(1)产生氢气的质量是多少?
(2)8g的锌、铜混合物中锌的质量是多少?
(3)反应后所得溶液中溶质的质量分数是多少?
【答案】(1)0.2g;(2)6.5g;(3)10%
【解析】
(1)根据质量守恒定律可得,H2的质量:8g+154.7g-162.5g=0.2g;
解:设8g的锌、铜混合物中锌的质量是x,反应后所得溶液中溶质的质量是y
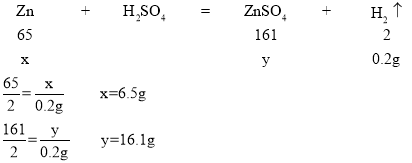
(2)解的锌的质量:6.5g;
(3)ZnSO4%=16.1g/[162.5g-(8g-6.5g)]×100%=10%
答:产生氢气的质量是0.2g,8g的锌、铜混合物中锌的质量是6.5g,反应后所得溶液中溶质的质量分数是10%。

练习册系列答案
相关题目