题目内容
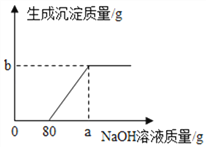
【题目】为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,
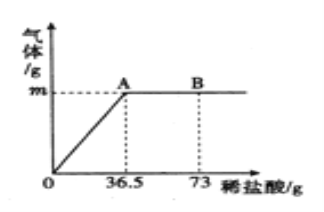
(1)A点产生气体的质量m为_______, 此时所得溶液的溶质质量为 ______。
(2)B点时,烧杯内溶液中粒子有__________________________。(写粒子符号)
【答案】 2.2 6.55g Na+、Cl—、H+、H2O
【解析】1)据质量守恒定律可知反应前后物质的总质量不变,故A点产生气体的质量m为6g+36.5g-40.3g=2.2g, 此时所得溶液的溶质为碳酸钠和盐酸反应生成的氯化钠,设生成氯化钠的质量为x,样品中碳酸钠的质量为y
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
106 117 44
y x 2.2g
![]() x=5.85g
x=5.85g
![]() y=5.3g A点时所得溶液的溶质质量为6g-5.3g+5.85g=6.55g。
y=5.3g A点时所得溶液的溶质质量为6g-5.3g+5.85g=6.55g。
(2)A点时恰好完全反应,溶质只有氯化钠,B点时,盐酸过量,烧杯内溶液中溶质是氯化钠和氯化氢,粒子有Na+、Cl—、H+、H2O。

【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】(1)草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O43H2O ![]() CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
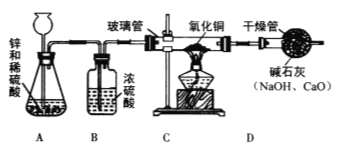
【问题讨论】为了测定铁红中铁的质量分数,小组间进行如下实验。(装置气密性良好)
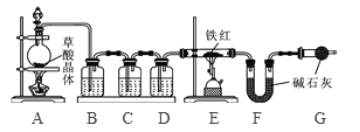
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是________(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 __________________________。
(3)写出E装置中所发生反应的一个化学方程式: _____________________。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 ____ < m < ______。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 _________。
【实验反思】 (1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 ________(选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 ___________________。
【题目】阅读下面短文,回答相关问题。
生活中你是否遇到过这样的事情:你将苹果去皮、切块儿,等待妈妈下班回来。可是一段时间后,苹果块儿表面会生成一种褐色的物质,口感也不那么脆了......变化其实来自于苹果中存在的一种原本无色的多酚类的物质。这类物质能跟氧气结合,产生一些有色物质,这就是褐变过程。
防止苹果发生褐变过程的方法有很多。
碳酸氢钠是一种安全、价格低廉的化学物质,能够直接抑制水果病原真菌的生长,常用于水果贮藏保鲜。选择新鲜、大小均匀、无虫害无伤的苹果果实,消毒、清洗后切成12片,每片厚度约为15mm。切片立即浸泡于下表中的碳酸氢钠溶液中进行保鲜处理。每种浓度的碳酸氢钠溶液中浸泡2块苹果切片。5分钟后将苹果切片捞出、甩干,将12片苹果装在一个塑料保鲜盒中,置于4℃贮藏观察。
1 | 2 | 3 | 4 | 5 | 6 | |
碳酸氢钠溶液的溶度g/L | 0 | 0.5 | 2.0 | 5.0 | 10.0 | 15.0 |
pH | 7.01 | 8.00 | 8.12 | 8.20 | 8.25 | 8.33 |
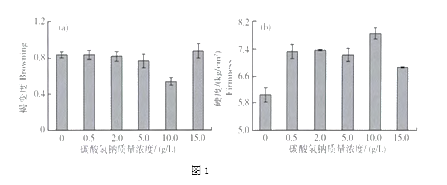
在贮藏3天后,取样测定其褐变度和硬度变化,记录的数据如下图1。
(注:褐变度表示苹果褐变的程度,数值越大褐变程度越高;硬度表示苹果的酥脆程度,数值越大说明越酥脆)
抗坏血酸(即维生素C)是一种抗氧化剂,也可以有效抑制苹果切分后褐变和变软。抗坏血酸在酸性环境下稳定,但是很难发挥抗氧化作用,在弱碱性环境下可以发挥很强的抗氧化作用。而苹果果实的pH一般在3.0~3.8。
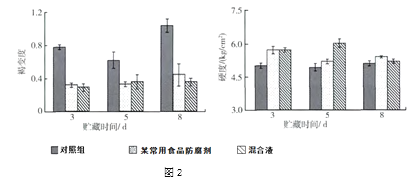
取三组苹果切片,分别用10g/L某常用食品防腐剂、10g/L碳酸氢钠与10g/L抗坏血酸的混合液、对照液(蒸馏水)处理,4℃贮存并观察,记录数据如下图2:
依据文章回答下列问题。
(1)苹果褐变的过程属于____变化(填“物理”或“化学”)。
(2)碳酸氢钠的俗称是_____(填序号)。
A.食盐 B.纯碱 C.小苏打 D.苛性钠
(3)由图1可知,用____ g/L碳酸氢钠溶液处理对鲜切苹果的褐变、变软抑制的效果更好。
(4)由实验可知:抗坏血酸溶液与碳酸氢钠溶液混用效果更好,试推测可能的原因是:_________。
(5)根据文中的实验数据,你对储存苹果切片有哪些建议_________。