题目内容
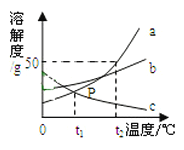
【题目】分析处理图表中的信息是学习化学的一种重要方法。 表3是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
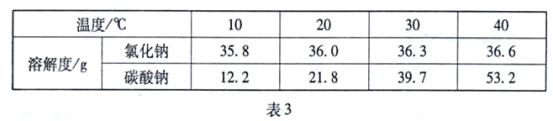
① 40℃时,氯化钠的溶解度为____________g。
② 碳酸钠的溶解度随温度的升高而____________(填“增大”或“减小”)。在20℃时, 将100g的水加入30 g碳酸钠中,充分搅拌后得到的是____________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为____________ (计算结果精确到0.1%)。
③ 10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的溶液是__________。
④你认为以上两种溶液适合用蒸发结晶的是_________,适合用降温结晶的是_____________
【答案】① 36.6 ②增大 饱和溶液 23.1%
③ 碳酸钠饱和溶液 ④ 氯化钠溶液 碳酸钠溶液
【解析】
试题分析:(1)由表格可知,①40℃时,氯化钠的溶解度为36.6g;②碳酸钠的溶解度随温度的升高而增大;在20℃时,碳酸钠的溶解度为21.8g,也就是在该温度下的100g水中最多溶解碳酸钠21.8g,此时加入30g不能完全溶解,形成了该温度下的饱和溶液; 30℃时碳酸钠的溶解度为39.7g,完全溶解了,此时溶液中溶质的质量分数为:30g30g+100g×100%≈23.1%;③10℃时,分别配制表中两种物质的饱和溶液,该温度下,溶解度小的,其饱和溶液中溶质的质量分数小, 据表碳酸钠的溶解度在10℃时氯化钠大于碳酸钠,故溶质质量分数较小的溶液是碳酸钠。④据表知氯化钠的溶解度受温度影响不大,使用蒸发结晶。而碳酸钠影响大,故用降温结晶。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目